
分析 (1)Na和水反应方程式为2Na+2H2O═2NaOH+H2↑,反应前后溶液质量增加量=钠的质量-氢气质量,根据差量法计算参加反应的Na的质量;
(2)根据转移电子守恒计算生成氢气质量,再根据V=$\frac{m}{ρ}$计算氢气体积;
(3)根据原子守恒计算n(NaOH),再根据m=nM计算NaOH质量,溶液中NaOH质量分数=$\frac{溶质质量}{溶液质量}×100%$.
解答 解:(1)Na和水反应方程式为2Na+2H2O═2NaOH+H2↑,反应前后溶液质量增加量=钠的质量-氢气质量,设参加反应的Na的质量为x,
2Na+2H2O═2NaOH+H2↑△m
46 44
x 52.2g-50.0g=2.2g
46:44=x:2.2g
x=$\frac{2.2g×46g}{44}$=2.3g,
答:参加反应的Na的质量为2.3g;
(2)n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,根据转移电子守恒得生成n(H2)=$\frac{0.1mol×1}{2}$=0.05mol,V(H2)=$\frac{m}{ρ}$=$\frac{0.05mol×2g/mol}{0.893g/L}$=0.112L,
答:所得氢气在常温下体积为0.112L;
(3)根据原子守恒得n(NaOH)=n(Na)=0.1mol,m(NaOH)=nM=0.1mol×40g/mol=4g,溶液中NaOH质量分数=$\frac{溶质质量}{溶液质量}×100%$=$\frac{4g}{52.2g}$×100%=7.7%,
答:溶液中氢氧化钠的质量分数为7.7%.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,知道差量法的正确运用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
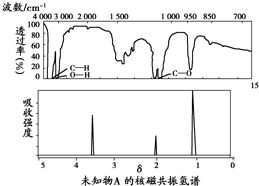
| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 由核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氢气即可发生加成反应 | |
| B. | 分子中含有3个C-C单键和三个C═C双键 | |
| C. | 分子中C、H元素的质量比为6:1 | |
| D. | 在空气中燃烧时产生浓烈的黑烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe3+、Br-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、NH4+、SO42-、Na+ | D. | Na+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
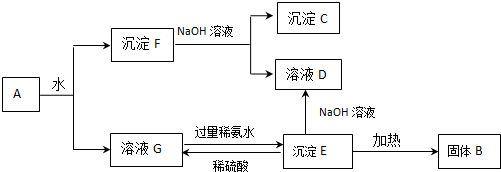
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 不断鼓入空气 | C. | 加入FeS2 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
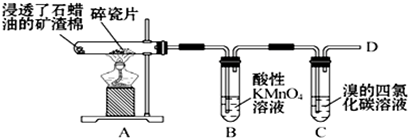
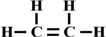 ,空间结构是平面型分子;
,空间结构是平面型分子;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CHO | B. | CH3CH2COOH | C. | CH3COCH3 | D. | CH3CH2OCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com