

分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)由图可知,从t1至t2时N2O4的物质的量变化量为4mol-3mol=1mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(N2O4);
(3)到达平衡时,反应混合物各组分的物质的量不发生变化,据此结合图象判断;
(4)t1时刻后,NO2浓度降低,N2O4浓度增大,未到达平衡状态,反应向正反应进行.
解答 解:(1)可逆反应2NO2?N2O4的平衡常数表达式$K=\frac{{c({N_2}{O_4})}}{{{c^2}{{(N{O_2})}^{\;}}}}$,故答案为:$K=\frac{{c({N_2}{O_4})}}{{{c^2}{{(N{O_2})}^{\;}}}}$;
(2)由图可知,从t1至t2时N2O4的物质的量变化量为4mol-3mol=1mol,故v(N2O4)=$\frac{\frac{1mol}{1L}}{20s-10s}$=0.1mol/(L•s),
故答案为:0.1;
(3)到达平衡时,反应混合物各组分的物质的量不发生变化,由图象可知,t3时刻处于平衡状态,故答案为:t3;
(4)t1时刻后,NO2浓度降低,N2O4浓度增大,未到达平衡状态,反应向正反应进行,故正反应速率大于逆反应速率,
故答案为:>.
点评 本题考查化学平衡图象、化学平衡常数、反应速率计算、化学平衡的影响因素等,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比均为1:1 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n | |
| D. | 元素周期表中L层电子为奇数的元素的化合价也都是奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n之比为2:3 | B. | 18Om和16On的物质的量比为1:1 | ||
| C. | 18Om和16On的质量比为3:4 | D. | 18Om和16On的密度为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
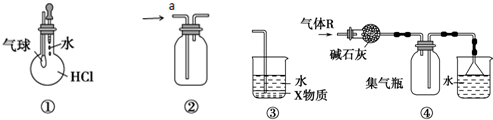
| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②a口进气可用于收集CO2、Cl2或NO等 | |
| C. | 装置③中X为四氯化碳,可用于吸收氨气或氯化氢 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
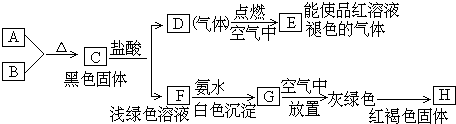
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com