
��2 L�ܱ�������ͨ��a mol���� A��b mol����B����һ�������·�����Ӧ��xA(g)��yB(g)  pC(g)��qD(g)
pC(g)��qD(g)
��֪��ƽ����Ӧ����vC��1/2vA����Ӧ2 minʱ��A��Ũ�ȼ�����1/3��B�����ʵ�������a/2mol����a mol D���ɡ�
�ش��������⣺
(1)��Ӧ2 min�ڣ�vA��________��vB��__________��
(2)��ѧ����ʽ�У�x��________��y��________��p��______��q��________��
(3)��Ӧƽ��ʱ��DΪ2a mol����B��ת����Ϊ__________��
(4)���ֻ���߷�Ӧ�¶ȣ�������Ӧ�������䣬ƽ��ʱDΪ 1.5a mol����÷�Ӧ�Ħ�H________0(�����������������)��
(5)��������������䣬���������ݻ���Ϊ1 L������ͬ����ʵ�飬����������Ӧ�Ƚϣ�
�ٷ�Ӧ����____________(���������С�����䡱)��������________________________________________________________��
��ƽ��ʱ��Ӧ���ת����__________(���������С�����䡱)��������
_________________________________________________________________��
(1)a/12 mol��L��1��min��1��a/8mol��L��1��min��1��(2)2��3��1��6��(3)a/b��100%��(4)<
(5)�����������С����Ӧ���Ũ���������ʹ��Ӧ�������ڼ�С�������С�������ѹǿ����ƽ����������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С
��������

ͬ���ɵ�vD��a/4mol��L��1��min��1
vC��1/2vA��a/24mol��L��1��min��1
(2)�ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ�л�ѧ������֮�ȿɵ�x��y��p��q��vA��vB��vC��vD��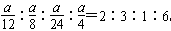 ��
��
(3)��DΪ2a molʱ��B������a mol�����B��ת����Ϊ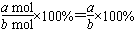 ��
��
(4)������������ֻ�����¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ���������֪ԭƽ��ʱDΪ2a mol�������¶ȴﵽ��ƽ��ʱ��DΪ1.5a mol���ɼ���Ӧ���淴Ӧ�����ƶ����������Ӧ�Ƿ��ȷ�Ӧ������H<0��
(5)ԭ�ܱ����������Ϊ2 L���ֱ�Ϊ1 L�������������䣬��Ӧ����������Ũ�ȶ�������˷�Ӧ��������С�����Ϊ��ѹ������ѹǿ��ƽ��Ӧ�����������֮��С�ķ����ƶ������ڷ�Ӧ����ʽΪ2A(g)��3B(g)  C(g)��6D(g)��������������֮��С�����ƽ�������ƶ�����Ӧ���ת���ʼ�С��
C(g)��6D(g)��������������֮��С�����ƽ�������ƶ�����Ӧ���ת���ʼ�С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��ɽ��ʡ������ѧ2011��2012ѧ���һ��ѧ���������⻯ѧ�������� ���ͣ�022
��2 L�ܱ�������ͨ��3 mol����A��1 mol����B����һ�������·�����Ӧ��3A(g)��B(g)![]() 2C(g)��qD(g)����֪��2 minʱ��Ӧ��ƽ�⣬A��Ϊ1.8 mol���һ�������ƽ����Է�����������
2C(g)��qD(g)����֪��2 minʱ��Ӧ��ƽ�⣬A��Ϊ1.8 mol���һ�������ƽ����Է�����������
�ش��������⣺
(1)q��ֵΪ________��
(2)��Ӧ2 min�ڣ�vA��________��vB��________��vC��________
(3)��Ӧƽ��ʱ��B��Ũ����________mol��L��1��D�����ʵ���Ϊ________mol��
(4)���ֻ���߷�Ӧ�¶ȣ�������Ӧ�������䣬������Ӧ�����ʽ�________���淴Ӧ�����ʽ�________(���������С�����䡱)����������������䣬���������ݻ���Ϊ1 L������ͬ����ʵ�飬����������Ӧ�Ƚϣ���Ӧ���ʽ�________(���������С�����䡱)��������________��
(5)���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ��˵����Ӧ���������________�������������(����ڣ�С�ڻ����)����0.5 mol����B��ȫ��Ӧ�ų�����Ϊa����÷�Ӧ�ų�������________2a(����ڣ�С�ڻ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ɹź��ױ�������ʯ��ҵһ�и����ڶ���ģ�⻯ѧ�Ծ����������� ���ͣ������
��10�֣�(1)һ�������£�������ӦCO (g)��H2O (g)  CO2(g) ��H2 (g)����2 L�ܱ�������ͨ��2 mol CO (g)��1 mol H2O (g)��2 min��Ӧ�ﵽƽ��ʱ�����CO�����ʵ���Ϊ1.6mol����H2O (g)��ʾ�÷�Ӧ����Ϊ________���¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ________�����������ټ���2 mol CO (g)�������´ﵽƽ��ʱ��CO��ת����________20%(�>������<������)��
CO2(g) ��H2 (g)����2 L�ܱ�������ͨ��2 mol CO (g)��1 mol H2O (g)��2 min��Ӧ�ﵽƽ��ʱ�����CO�����ʵ���Ϊ1.6mol����H2O (g)��ʾ�÷�Ӧ����Ϊ________���¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ________�����������ټ���2 mol CO (g)�������´ﵽƽ��ʱ��CO��ת����________20%(�>������<������)��
(2)��һ�ܱ������з�����Ӧ 2 NO2 2NO��O2 ��H>0����Ӧ������NO2��Ũ����ʱ��仯���������ͼ��ʾ��
2NO��O2 ��H>0����Ӧ������NO2��Ũ����ʱ��仯���������ͼ��ʾ��
��ش�������A��B�ֱ��ʾ���Ǹ÷�Ӧ��ij��ͬ�����µķ�Ӧ�����������B������������________(�����ѹǿ���� ����Сѹǿ���������¶ȡ��������¶ȡ���ʹ�ô�����)��
(3)һ���¶��£����ܱ�������N2O5�ɷ������з�Ӧ��
��2N2O5(g)  4NO2(g)��O2(g)
4NO2(g)��O2(g)
��2NO2(g)  2NO(g)��O2(g)
2NO(g)��O2(g)
����ƽ��ʱ��c(NO2)��0.6 mol/L��c(O2)��1.3 mol/L����Ӧ����NO2��ת����Ϊ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ר���� ���ͣ������
 pC(g)��qD(g) ��֪��ƽ����Ӧ����vC��1/2vA����Ӧ2 minʱ��A��Ũ�ȼ�����1/3��B�����ʵ���������a2 mol����a mol D���ɣ��ش��������⣺
pC(g)��qD(g) ��֪��ƽ����Ӧ����vC��1/2vA����Ӧ2 minʱ��A��Ũ�ȼ�����1/3��B�����ʵ���������a2 mol����a mol D���ɣ��ش��������⣺ �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣���������͵����������Ǵ�������Ҫ��Ⱦ���ֹ������������Ⱦ�ǵ�ǰ������������Ҫ�о�����֮һ��
�� һ�������£�2SO2(g)+O2(g)![]() 2SO3(g)����2 L�ܱ�������ͨ��2 mol SO2(g)��1 mol O2(g)��2 min��Ӧ�ﵽƽ��ʱ����������к�SO31.8mol����ÿ��淴Ӧ��ƽ�ⳣ��K�������������������������£������������ټ���2 mol SO2(g)��1 mol O2(g)�� ���´ﵽƽ��� mol<SO3< mol��
2SO3(g)����2 L�ܱ�������ͨ��2 mol SO2(g)��1 mol O2(g)��2 min��Ӧ�ﵽƽ��ʱ����������к�SO31.8mol����ÿ��淴Ӧ��ƽ�ⳣ��K�������������������������£������������ټ���2 mol SO2(g)��1 mol O2(g)�� ���´ﵽƽ��� mol<SO3< mol��
�� ��CH4����ԭNOxΪN2�������������������Ⱦ������1 L NO2��NO�������NOx�����仹ԭ��N2����ͬ��ͬѹ��CH4�����0.4 L������������NO2��NO��������֮��Ϊ ��
�� �������ײ�����ȱλ�����Σ�ZnFe2Ox�����������Σ�ZnFe2O4�������»�ԭ�Ƶã������£�����ʹ��ҵ�����е�����������ֽ��ȥ��ת��������ͼ��ʾ��
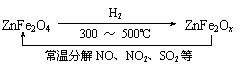
��2 mol ZnFe2Ox��SO2������0.75 mol S��x�� ��������ɷֽ���л���������V����״���£�����д��������̣�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com