
| A. | 升高温度,正向反应速率减小,逆向反应速率增大 | |
| B. | 升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
分析 A.升高温度,正逆反应速率都增加;
B.升高温度,化学反应速率增加,缩短达到平衡的时间;
C.增大压强化学平衡向着气体物质的量减小的正反应方向移动;
D.减小压强化学平衡向着气体物质的量增大的逆向移动.
解答 解:A.升高温度,化学反应速率增加,正向反应速率增加,逆向反应速率也增加,故A错误;
B.升高温度,化学反应速率增加,从而缩短达到平衡的时间,故B正确;
C.升高温度化学平衡向着吸热方向进行,即向逆向移动,增大压强化学平衡向着气体物质的量减小的正向移动,故C错误;
D.降低温度化学平衡向着放热方向进行,即向着正向移动,减小压强化学平衡向着气体物质的量增大的方向进行,即逆向移动,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确温度、压强对化学平衡、反应速率的影响即可解答,A为易错点,注意需要分别分析温度对反应速率、化学平衡的影响,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1820 | 2750 | 11600 |
| A. | 元素X的常见化合价是+3 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氯元素形成化合物时,化学式可能是XCl2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
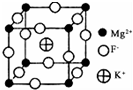 卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.
卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
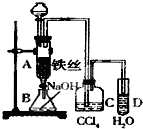 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
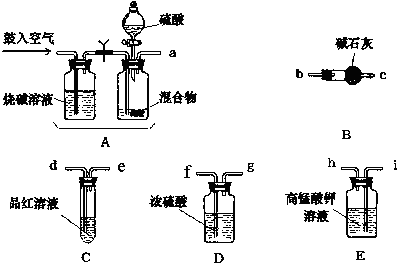
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
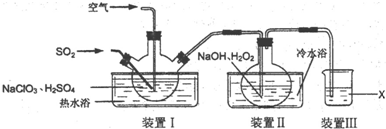
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH•H2O═AlO2-+4NH4++2H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 氢氧化铁胶体 | 铁 | 碳酸钙 |
| D | 水银 | 澄清石灰水 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com