
【题目】“荧光粉”所用的高纯度氯化钙中若混有镁离子,除去的方法是把氯化钙的水溶液加热到90﹣95℃,在不断搅拌的条件下加入适当的沉淀剂,使镁离子生成沉淀过滤除去.此沉淀剂最好是( )
A.烧碱
B.纯碱
C.小苏打
D.石灰浆
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是
A.在水中溶解性:Na2CO3>NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3
D.Na2CO3与NaHCO3相互转化的反应是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法中,不正确的是
A. 1mol甲烷中含有4mol C—H共价健
B. CH4、CCl4和CH3Cl都是正四面体结构
C. 光照条件下甲烷能与溴蒸气发生取代反应
D. 通常情况下,甲烷跟强酸、强碱、强氧化剂不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的改进实验操作如下:取一张滤纸,用酚酞试液浸润并晾干,裁剪并折叠成信封状,滤纸内放一小块(约绿豆粒般大小)金属钠,把含钠的滤纸信封放入水中,装置如下图所示。

请回答:
(1)写出金属钠与水反应的离子方程式________________。
(2)实验过程中取用金属钠的操作方法是________________。
(3)有关此实验的说法正确的是________________。
A.实验过程中,可能听到爆鸣声
B.实验过程中,看到滤纸信封由白色逐渐变红色
C.实验改进的优点之一是由实验现象能直接得出反应产物
D.实验过程中,多余的金属钠不能放回原试剂瓶中,以免对瓶内试剂产生污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________,可燃冰(mCH4·nH2O)属于________晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
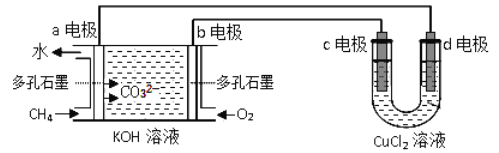
①b电极名称为___________,d电极的电极反应式为_________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H1 2CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:

己知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1。则y=___________。
2NH3(g) △H=-92kJ·mol-1。则y=___________。
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是( )

A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的名称或俗名与化学式相对应的
A. 小苏打——Na2CO3 B. 火碱——Na2O2
C. 磁性氧化铁——Fe2O3 D. 醋酸——CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中氢氧根离子浓度________(填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式________________;所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因______________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则c(SO42-)=________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4,在调节溶液pH值时应选用的试剂是
A. NaOH B. NH3·H2O C. ZnO D. Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com