
| A、H2S水溶液呈酸性:H2S=H++HS- |
| B、醋酸钠溶液和硫酸氢钠混合:CH3COO-+H+=CH3COOH |
| C、向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3+H2O |
| D、碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- |


科目:高中化学 来源: 题型:
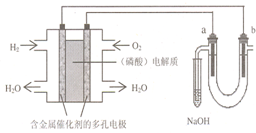 用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )| A、电池工作时,负极反应式为:H2+2 OH--2e-=2H2O |
| B、电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、忽略能量损耗,当电池中消耗0.32g O2时,b 极周围会产生0.04g H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃瓶中 |
| B、氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
| C、汽油或煤油存放在带橡皮塞的棕色玻璃瓶中 |
| D、碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中氧化剂与还原剂的物质的量比值为3:2 |
| B、反应中NaOH既不是氧化剂也不是还原剂 |
| C、当有0.2mol Fe(OH)3参加反应时转移的电子数目为1.204×1023 |
| D、反应中NaClO被还原,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
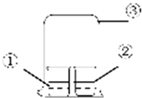 用图中所示的装置进行实验,实验现象与预测不一致的是( )
用图中所示的装置进行实验,实验现象与预测不一致的是( )| ①中的物质 | ②中的物质 | 预测现象 | |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液为蓝色 |
| D | 饱和亚硫酸溶液 | 蓝色石蕊试液 | ②中溶液先变红又褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸银溶液存放在无色试剂瓶中 |
| B、金属钠保存在CCl4中(钠的密度小于CCl4) |
C、 浓硫酸的装运包装箱应贴上如图所示的标识 |
| D、氢氧化钠溶液保存在带玻璃塞的玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在测定硫酸铜晶体结晶水含量的实验中,最少称量4次 |
| B、使用pH试纸测定溶液的pH时,首先用蒸馏水润湿pH试纸的做法是错误的,测定的结果也一定是错误的 |
| C、配制一定物质的量浓度额溶液,容量瓶内有蒸馏水对配制结果无影响 |
| D、酸碱中和滴定时,锥形瓶内有蒸馏水对滴定结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al箔在空气中受热可以熔化,且发生剧烈燃烧 |
| B、Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 |
| C、Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com