
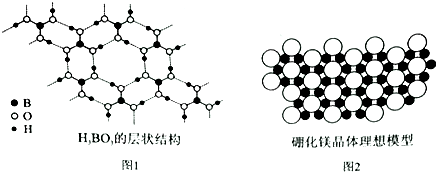
 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.分析 (1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)原子个数相等、价电子数相等的微粒互为等电子体,等电子体的结构相似;
(4)根据元素守恒可写出合成磷化硼的化学反应方程式;根据图知,该晶胞是面心立方最密堆积,若该晶体中最邻近的两个P原子之间的距离为a pm,晶胞的棱长=$\sqrt{2}$apm,该晶胞中P原子个数=$8×\frac{1}{8}$+6×$\frac{1}{2}$=4,B原子个数为4,晶胞密度=$\frac{4×\frac{M}{Na}}{(\sqrt{2}a×1{0}^{-10})^{3}}$;
(5)利用均摊法计算含1molH3BO3的晶体中的氢键;[B(OH)4]-中B原子的价层电子对数分析;
(6)1个B原子为3个Mg原子共用,1个Mg原子为6个B原子共用,利用均摊法计算硼原子和镁原子的个数比.
解答 解:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p1,故答案为:1s22s22p1;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以三种元素的第一电离能由大到小的顺序为N>O>B,故答案为:N>O>B;
(3)原子个数相等、价电子数相等的微粒互为等电子体,可知SO3等符合,故答案为:SO3(其他合理答案也对);
(4)根据元素守恒可知由三溴化硼和三溴化磷在氢气中高温反应合成磷化硼的化学反应方程式为BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr,
根据图知,该晶胞是面心立方最密堆积,若该晶体中最邻近的两个P原子之间的距离为a pm,晶胞的棱长=$\sqrt{2}$apm,该晶胞中P原子个数=$8×\frac{1}{8}$+6×$\frac{1}{2}$=4,B原子个数为4,晶胞密度=$\frac{4×\frac{M}{{N}_{a}}}{(\sqrt{2}a×1{0}^{-10})^{3}}$,故答案为:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr;$\frac{4×\frac{M}{{N}_{a}}}{(\sqrt{2}a×1{0}^{-10})^{3}}$;
(5)一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,[B(OH)4]-中B原子形成4个共价键,则B原子的价层电子对数为4,为sp3杂化,没有孤电子对,空间结构为正四面体型;
故答案为:3;正四面体型;
(6)根据投影可知,1个B原子为3个Mg原子共用,故属于一个Mg原子的B原子为$\frac{1}{3}$;1个Mg原子为6个B原子共用,故用于一个B原子的Mg原子为$\frac{1}{6}$.由此可知Mg镁硼原子个数比=1:2,故硼化镁的化学式为MgB2,故答案为:MgB2.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、等电子体、晶体类型判断等知识点,明确基本原理、基本计算机物质空间结构是解本题关键,侧重考查学生分析判断及计算能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 要提纯的物质(杂质) | C2H5OH (H2O) | CH3CH2OH (CH3COOH) | C6H5Br (Br2) | C6H6 (C6H5OH) |
| 选用试剂(1) | c | b或d | b | b |
| 分离方法(2) | C | C | B | B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol Fe与1mol Cl2反应时转移的电子数目为3NA | |
| B. | 3g C18O和14CO的混合物中所含电子、中子数目为1.4NA | |
| C. | 0℃、101kPa下,0.1mol 乙炔和甲醛(HCHO)的混合物中含有C-H数目为0.2NA | |
| D. | 50ml 18mo•L-1浓H2SO4与足量的Cu充分反应,能收集到SO2的分子数目为0.45NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

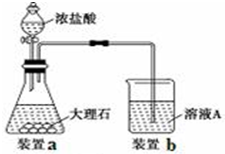

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以煤、石油和天然气为主要原料生产的合成材料是塑料、合成橡胶、合成纤维 | |
| B. | 煤是工业上获得芳香烃的一种重要来源 | |
| C. | 石油的裂解是为了提高轻质油(例如汽油)的产量 | |
| D. | 天然气的主要成分是甲烷,属于不可再生资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
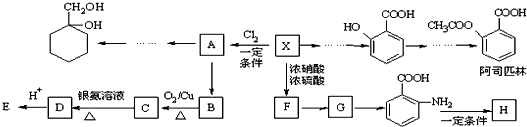
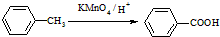
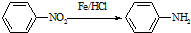 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
.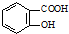 的同分异构体的结构简式
的同分异构体的结构简式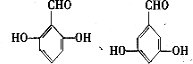 .(写出2种)
.(写出2种)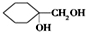 ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
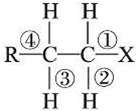
| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是①和④ | |
| D. | 发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com