
| A、16g O2与O3混合物中所含电子数为8NA |
| B、标准状况下,2.24LCH3OH分子中共用电子对数为0.5NA |
| C、6gSiO2晶体中硅氧共价键数为0.4NA |
| D、0.1mol13C18O中所含中子数为1.7NA |
| 6g |
| 60g/mol |
| 6g |
| 60g/mol |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
 如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,
如图所示,隔板I、Ⅱ均可自由移动,保持温度相同,查看答案和解析>>
科目:高中化学 来源: 题型:
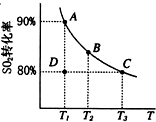
| 催化剂 |
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
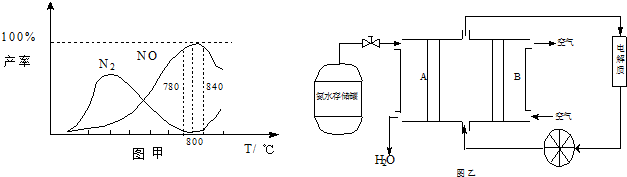
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 |
| B、CO |
| C、NaOH |
| D、C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2与足量的铁反应,转移的电子数为2NA |
| B、在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA |
| C、在熔融状态下,1 mol NaHSO4完全电离出的阳离子数目为2NA |
| D、将0.1 mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、丁中SO3的平衡转化率为α3=80% |
| B、该温度下,平衡常数的值为400 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率小于乙中O2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com