
����Ŀ�������仯�����ڹ�ҵ�����Ϳ�����������Ҫ����;����ش��������⣺
��1����̬ Ni ԭ���У���������������ߵ��ܼ�����Ϊ_________���۲���ӵĹ������ʽΪ_________��
��2��Ni�����������ṹ��ͼ��ʾ��
A B
��A ���ۡ��е����B��ԭ��Ϊ_________��
��A���庬�л�ѧ��������Ϊ___________����ѡ����ĸ����
A������ B������ C����� D��������
��A������Nԭ�ӵ��ӻ���ʽ��_________��
��3�� �˹��ϳɵ��黯�������ڸ���ȱ�ݣ�ijȱ���黯�������ΪNi1.2As�� ���� Ni Ԫ��ֻ�У�2 �ͣ�3 ���ּ�̬�� ���ּ�̬����������Ŀ֮��Ϊ_________��
��4�� NiAs�ľ����ṹ��ͼ��ʾ��

�������ӵ���λ��Ϊ_________��
���������ӵ�������ֵΪNA�������ܶ�Ϊ �� g��cm��3����þ����������������֮��ľ���Ϊ_________pm��
���𰸡� 3d ![]() A�к���� ABC sp2 1:1 4
A���� ABC sp2 1:1 4 ![]() ��
�� ![]()
��������(1)����ԭ������Ϊ28��������Ų�ʽΪ1S22S22P63S23P64S23d8����۵��ӵĹ������ʽΪ![]() �����Ի�̬��ԭ�Ӻ����������������ߵ��ܼ�����Ϊ3d��
�����Ի�̬��ԭ�Ӻ����������������ߵ��ܼ�����Ϊ3d��
(2)A����O��H������B��û�У�����O��H�������ʿ��ڷ��Ӽ��γ������ʹ���ʵ��۷е���������A�ķ��ӽṹ����C=N˫�����������������������м�ͷ��ʾ����λ������ѡABC�����е�Nԭ����sp2��ʽ�ӻ���
(3)ijȱ���黯�������ΪNi1.2As�� ����NiԪ��ֻ�У�2�ͣ�3���ּ�̬���裫2�۵�NiΪx����+3�۵�NiΪy��������ԭ���غ��x+y=1.2���ɻ��ϼ�ԭ���2x+3y=3�����x=y=0.6���������ּ�̬����������Ŀ֮��Ϊ1:1��
(4) ��NiAs�ľ����ṹ������֪����һ��Ni3+��������ĵȾ�As3-Ϊ2��2=4�������������ӵ���λ��Ϊ4���þ����к��е�Ni3+Ϊ(1/8)��8+(1/2)��6=4�����е�As3-Ϊ4��������4��NiAs���������ⳤΪacm��������Ϊ(134��4)/ NA g������a=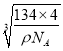 cm����As3-λ����1/8���������ģ�����As3-��ľ����൱����Խ��ߵ�һ�룬��
cm����As3-λ����1/8���������ģ�����As3-��ľ����൱����Խ��ߵ�һ�룬��![]() a=
a=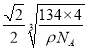 ��1010pm��
��1010pm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӵ��ε���Ҫ�ɷ���NaCl����������������KIO3������˵������ȷ���� ( )
A. KIO3��NaClΪ���ӻ������ֻ�����Ӽ�
B. KIO3�������ӵĽṹʾ��ͼΪ![]()
C. 23Na37Cl����������������֮����8��7
D. �ε���ĽṹʽΪH��O��I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������17�����ʻ���ţ�����Ҫ����գ�
��Һ�Ȣ�  ��CH2�TCH��CH3����������ˮ��
��CH2�TCH��CH3����������ˮ�� ![]() Cl��
Cl�� ![]() ��������CH3CH2CHO�����
��������CH3CH2CHO����� ![]()
![]() CH��CH
CH��CH 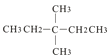 H2�һ�CH3CH2OH
H2�һ�CH3CH2OH
��1��д���ĵ���ʽ�� ��
��2����ϵͳ���������� �� �䷢����ȥ��Ӧ�ɵõ�����ϩ������Ҫ���������칹��
��3��1mol����mol���ڹ��������³�ַ�Ӧ����ȫ�ȴ��飮
��4��д���������Ƶ�������ͭ����Һ���ȷ�Ӧ�Ļ�ѧ��Ӧ����ʽ ��
��5�����������л�Ϊͬϵ��� �� ��Ϊͬ���칹��� �� �������ţ���Ϊͬλ�ص� �� ��Ϊͬ��������� �� ����ͬ�����ʵ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����84����Һ����������Һ��Ӧ������ȡ��������Ӧԭ��Ϊ��NaClO + NaCl + H2SO4 ![]() Na2SO4 + Cl2��+ H2O�� Ϊ̽�����������ʣ�ijͬѧ���ô�ԭ���������������������ʾ��ʵ��װ�ã�
Na2SO4 + Cl2��+ H2O�� Ϊ̽�����������ʣ�ijͬѧ���ô�ԭ���������������������ʾ��ʵ��װ�ã�
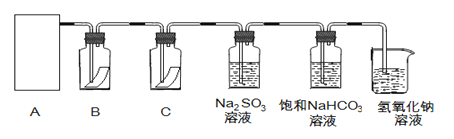
��1���Ӣ١��ڡ���װ����ѡ����ʵ�������װ�ã�A����___________ (��д���)��
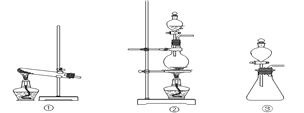
��2��װ��B��C�����ηŵ��Ǹ���ĺ�ɫ������ʪ��ĺ�ɫ������ʵ������и�ͬѧ����װ��B�еIJ���Ҳ��ɫ����ԭ�������__________��˵����װ�ô������Ե�ȱ�ݣ�����������ĸĽ��ķ��� _______________________________��
��3��Ϊ����֤�����������ԣ�������ͨ��Na2SO3��Һ�У�Ȼ����鷴Ӧ����Һ���Ƿ���SO42-��д��������Na2SO3��Һ��Ӧ�����ӷ���ʽ ________________�����鷴Ӧ����Һ�к���SO42-�ķ�����ȡ������Ӧ����Һ���Թ��У��ȼ���������_____������������Ȼ���ټ�������____��Һ�а�ɫ�������ɣ�˵������SO42-��
��4������ͨ�뱥��NaHCO3��Һ�ܲ�����ɫ���壬��֪����:����>̼��>�����ᣬ��ʵ��֤��������ˮ��Ӧ���������к��� ________________ ������ᡱ�����ᡱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA���������ӵ�������ֵ�������й�˵����ȷ���ǣ� ��
A. 1mol���ᡢ�Ҵ��ͼ�������Ļ�����к��е�̼ԭ����Ϊ2NA
B. 46gNa��һ����O2��ȫ��Ӧ����Na2O��Na2O2ʱת�Ƶĵ�����Ϊ3NA
C. 0.5L1mol��L-1��NaHS��Һ�к��е�HS-��S2-������Ϊ0.5NA
D. 2molNO��1molO2��ַ�Ӧ��,��ϵ�к��е�NO2������Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����C��H��O����Ԫ����ɣ������к���8��ԭ�ӣ�1mol���л��ﺬ��46mol���ӣ���ȫȼ�ո��л�������ͬ�����²ⶨCO2��ˮ���������Ϊ2��1��ȡ2.7g���л���ǡ����30mL 1mol/L��̼������Һ��ȫ��Ӧ������д����Ҫ�ļ�����̣���
��1���л������ʽ��
��2���л���ṹ��ʽ��
��3��д�����л�����һ�����������Ҷ�����Ӧ������Ԫ��״������ķ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״�л���M(����ʽΪC4H6O2)�ڴ��������¿���H2�����ӳɷ�Ӧ�����л���N(����ʽΪC4H8O2),�����й�˵������ȷ����(�������������칹)�� ��
A. ��M�����������л���,��M�Ľṹ��3��
B. ��M���������л���,��M�Ľṹ��4��
C. ��M�����������л���,��M�ļӳɲ���N�Ľṹ��2��
D. ��M���������л���,��M�ļӳɲ���N�Ľṹ��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴Ӧ��A��g��+3B��g��2C��g������H��0���м��������ݻ�Ϊ0.5L���ܱ���������������м���1molA�ĺ�3molB��һ�������´ﵽƽ��ʱ�ų�����ΪQ1kJ������ͬ�����£����������м���2molC�ﵽƽ��ʱ��������ΪQ2kJ����֪Q2=3Q1 �� ����������ȷ���ǣ� ��
A.���е��Ȼ�ѧ����ʽΪ2C��g��A��g��+3B��g������H=+4Q2/3kJ/mol
B.��Ӧ�ﵽƽ��ǰ������ʼ����v������v�� �� ����ʼ����v������v��
C.�ڸ������£���Ӧ2C��g��A��g��+3B��g����ƽ�ⳣ��Ϊ9��1.52��mol/L��2
D.����C��ת����Ϊ25%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com