
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
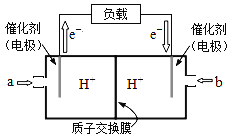
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
【答案】 H2(g)+1/2O2(g)═ H2O(l)△H= - 286 kJ/mol a 右 2CH3OH + 2H2O - 12e-═2CO2 + 12H+ 391 31kJ △H= +226.7kJmol-1
【解析】(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,2g即1molH2在氧气中燃烧生成液态水,放出286kJ热量,则H2的燃烧热的热化学方程式为H2(g)+![]() O2(g)═ H2O(l)△H= - 286 kJ/mol;(2)原电池中电子从负极经外电路流向正极,根据电子流向可知a电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为2CH3OH + 2H2O - 12e-═2CO2 + 12H+;(3)N2(g)+3H2(g)2NH3(g)△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,a=391 kJmol-1;当可逆反应中净生成N-H物质的量为2mol时,即生成
O2(g)═ H2O(l)△H= - 286 kJ/mol;(2)原电池中电子从负极经外电路流向正极,根据电子流向可知a电极为负极,甲醇在负极上发生氧化反应,氢离子移向正极右侧,电极反应式为2CH3OH + 2H2O - 12e-═2CO2 + 12H+;(3)N2(g)+3H2(g)2NH3(g)△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,a=391 kJmol-1;当可逆反应中净生成N-H物质的量为2mol时,即生成![]() molNH3,根据反应N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol可知,反应放热Q=
molNH3,根据反应N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol可知,反应放热Q=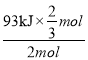 =31kJ;
=31kJ;
(4)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
利用盖斯定律将①×2+②×![]() -③×
-③×![]() 可得:
可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+![]() ×(-571.6kJ/mol)-
×(-571.6kJ/mol)-![]() ×(-2599 kJ/mol)=+226.7kJmol-1。
×(-2599 kJ/mol)=+226.7kJmol-1。


科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓
B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌
D.超导材料K3C60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
A.1 mol D2O分子所含的中子数为8NA
B.48 g氧气和臭氧的混合气体中的氧原子数为3NA
C.11.2 L 甲烷(CH4)中的共价键数为2NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)FeCl3溶液中加入KSCN呈红色,写出离子方程式_________________________。
(2)NaHCO3溶液显碱性的原因_________________________。
(3)NH4Cl溶液加入锌粒产生气体的离子方程式_________________________。
(4)已知16克固体硫充分燃烧放出148.4kJ的热量,则该反应的热化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
![]()
A. H2SO4 B. NaCl C. AgNO3 D. K2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com