

分析 废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2•xH2O,过滤,滤渣为TiO2•xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加碳酸氢铵碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体,
(1)实现固体和液体的分离用过滤的方法;
(2)碳酸氢铵与硫酸亚铁发生双水解反应生成碳酸亚铁、二氧化碳气体、硫酸铵和水,据此判断B;
(3)根据沉淀溶解平衡的移动以及碳酸根离子乳酸之间反应的原理来回答;
(4)亚铁离子易被氧气氧化;
(5)根据水解原理:盐+水=酸+碱,结合水解产物是TiO2•xH2O来书写;
(6)根据氧化还原方程式并结合概念确定氧化剂和还原剂,进而确定物质的量之比;
(7)根据铁元素质量守恒可知硫酸亚铁晶体的物质的量,然后计算出样品中FeSO4•7H2O的质量分数.
解答 解:废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加铁屑,Fe与H2SO4和少量Fe2(SO4)3反应生成FeSO4,TiOSO4水解生成TiO2•xH2O,过滤,滤渣为TiO2•xH2O、Fe,滤液为FeSO4,FeSO4溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到硫酸亚铁晶体,脱水、煅烧得到氧化铁;FeSO4溶液中加碳酸氢铵碳酸亚铁沉淀、硫酸铵和二氧化碳,碳酸亚铁沉淀加乳酸溶解生成乳酸亚铁溶液和二氧化碳,乳酸亚铁溶液通过蒸发浓缩、冷却结晶、过滤洗涤得到乳酸亚铁晶体,
(1)分离硫酸亚铁溶液和滤渣的操作是过滤,
故答案为:过滤;
(2)步骤④的碳酸氢铵和硫酸亚铁反应生成碳酸亚铁、硫酸铵、二氧化碳气体和水,所以得到的B为(NH4)2SO4,
故答案为:(NH4)2SO4;
(3)根据碳酸铁的沉淀溶解平衡原理:FeCO3(s)?Fe2+(aq)+CO32-(aq),加入乳酸,这样CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液,
故答案为:FeCO3(s)?Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液;
(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化,
故答案为:防止Fe2+被氧化;
(5)TiOSO4水解生成TiO2•xH2O的化学方程式为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4,改写成离子方程式为:TiO2++(x+1)H2O═TiO2•xH2O↓+2H+,
故答案为:TiO2++(x+1)H2O═TiO2•xH2O↓+2H+;
(6)硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式为:4FeSO4+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO3,氧化剂是氧气,还原剂是氧化铁,所以氧化剂和还原剂的物质的量之比为1:4,
故答案为:1:4;
(7)②中所得晶体样品ag经步骤③得到的铁红含bmolFe2O3,根据铁元素质量守恒可知ag硫酸亚铁晶体样品中含有FeSO4•7H2O的物质的量为:2bmol,
所以晶体中FeSO4•7H2O的质量分数为:$\frac{278g/mol×2bmol}{ag}$=$\frac{556b}{a}$,
故答案为:$\frac{556b}{a}$.
点评 本题考查了物质制备方案的设计方法,题目难度中等,明确制备原理及常见物质的性质为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子种类由质子数和中子数共同决定 | |
| B. | 质子数相同的粒子一定属于同种元素 | |
| C. | 元素的性质主要由元素原子的最外层电子数决定 | |
| D. | 同位素的物理性质有差别而化学性质几乎完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
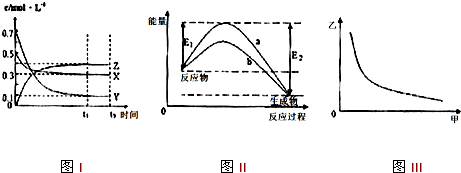
| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
; (写出名称):苯甲醇
(写出名称):苯甲醇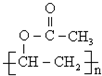 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com