
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.分析 A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素.
(1)基态S原子中电子占据的最高能层为第3能层;
(2)Fe2+离子的价层电子排布3d6,根据泡利原理、洪特规则画出价层电子排布图;F为Cu元素,原子核外有29个电子,根据能量最低原理书写核外电子排布式;
(3)碳元素的最高价氧化物对应的水化物为H2CO3,分子结构式为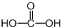 ,中心C原子成3个σ键、没有孤电子对,碳原子杂化轨道数目为3;B的气态氢化物为NH3,价层电子对数为4;
,中心C原子成3个σ键、没有孤电子对,碳原子杂化轨道数目为3;B的气态氢化物为NH3,价层电子对数为4;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-中C原子与S、N原子之间形成2对共用电子对;Fe3+离子与SCN-形成的配合物颜色为血红色;
(5)利用均摊法计算晶胞中S、Fe、Cu原子数目,进而确定化学式,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:A、B、C、D四种短周期元素,它们的核电荷数依次增大,A原子、C原子的L能层中都有两个未成对的电子,则A原子核外电子排布为1s22s22p2,C原子核外电子排布为1s22s22p4,故A为碳元素、C为氧元素;B原子序数介于C、O之间,则B为氮元素;C、D同主族,则D为S元素;E、F都是第四周期元素,E原子核外有4个未成对电子,原子核外电子排布为1s22s22p63s23p63d64s2,则E为Fe;F原子除最外能层只有1个电子外,其余各能层均为全充满,F原子核外电子数=2+8+18+1=29,则F为Cu元素.
(1)基态S原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,
故答案为:M;9;
(2)Fe2+离子的价层电子排布3d6,其价层电子排布图是 ,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
,F为Cu元素,原子核外有29个电子,原子的电子排布式是1s22s22p63s23p63d104s1,
故答案为: ;1s22s22p63s23p63d104s1;
;1s22s22p63s23p63d104s1;
(3)碳元素的最高价氧化物对应的水化物为H2CO3,分子结构式为 ,中心C原子成3个σ键、没有孤电子对,C原子采取sp2杂化方式;B的气态氢化物为NH3,N原子价层电子对数为4,价层电子对互斥模型为四面体形,
,中心C原子成3个σ键、没有孤电子对,C原子采取sp2杂化方式;B的气态氢化物为NH3,N原子价层电子对数为4,价层电子对互斥模型为四面体形,
故答案为:sp2;四面体形;
(4)化合物CO2、N2O和阴离子SCN-互为等电子体,它们结构相似,SCN-中C原子与S、N原子之间形成2对共用电子对,SCN-的电子式为 ,Fe3+离子与SCN-形成的配合物颜色为血红色,
,Fe3+离子与SCN-形成的配合物颜色为血红色,
故答案为: ;血红色;
;血红色;
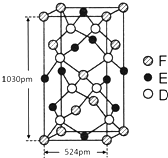
(5)晶胞中D(S)原子位于晶胞内部,原子数目为8个,E(Fe)原子6个位于面上、4个位于棱上,E(Fe)原子数目=6×$\frac{1}{2}$+4×$\frac{1}{2}$=4,F(Cu)原子位于4个位于面上、1个内部、8个顶点上,原子数目=4×$\frac{1}{2}$+1+8×$\frac{1}{8}$=4,晶体中Cu、Fe、S原子数目之比=4:4:8=1:1:2,故该晶体化学式为:CuFeS2,
晶胞质量=$\frac{(56+64+32×2)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$×4,晶胞体积=(524×10-10 cm)2×1030×10-10 cm,
该晶体的密度d=($\frac{(56+64+32×2)g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$×4×4)÷[(524×10-10 cm)2×1030×10-10 cm]=4.32g/cm3,
故答案为:CuFeS2;4.32.
点评 本题是对考查物质结构的考查,涉及核外电子排布、杂化理论、等电子体、配合物、晶胞计算等,需要学生具备扎实的基础,(5)为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
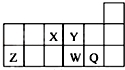
| A. | 元素Y的氢化物比元素X的氢化物稳定 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
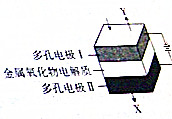
| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
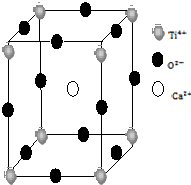 金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.
金属Ti性能优越,被誉为继Fe、Al后广泛应用的“第三金属”.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
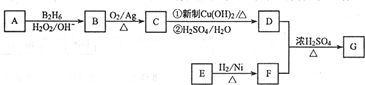
 .
. .
. (写出一种即可).
(写出一种即可).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | N2的电子式: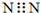 | ||
| C. | 硫离子结构示意图: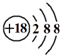 | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ⑨ |
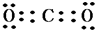 ,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为
,①、⑥两种元素能形成含共价键的离子化合物,该化合物的电子式为 ;用电子式表示元素③和⑨形成化合物的过程
;用电子式表示元素③和⑨形成化合物的过程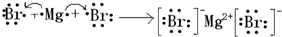
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com