
【题目】(1)给定条件下的下列四种物质:①标准状况下112mL液态水,②含有40mol质子的NH3, ③2mol的乙醇,④4g氦气,则上述物质中所含分子数目由多到少的顺序是________________(填序号)。
(2)标准状况下,0.51g某气体的体积为672mL,则该气体相对分子质量为______。
(3)将100mLH2SO4和HCl混合溶液分成两等份,一份中加入含0.2molNaOH溶液时恰好中和完全,向另一份中加入含0.05molBaCl2溶液时恰好沉淀完全,则原溶液中c(Cl-)=_________。
(4)标准状况下,VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为ρg/mL,则所得溶液溶质物质的量浓度=________________mol/L。
【答案】 ①>②>③>④ 17 2mol/L 1000ρv/(17v+22400)
【解析】本题主要考查有关物质的量的计算。
(1)①标准状况下112mL液态水的质量是112g,其物质的量是14mol;②氨分子含有10个电子,含有40mol质子的NH3的物质的量是4mol;③2mol的乙醇,④4g氦气的物质的量是1mol,物质的量之比等于分子数之比,则上述物质中所含分子数目由多到少的顺序是①>②>③>④。
(2)n=![]() =
=![]() ,M=
,M=![]() =
=![]() ,M=17g/mol,则该气体相对分子质量为17。
,M=17g/mol,则该气体相对分子质量为17。
(3)n(![]() )=n(BaCl2)=0.05mol,n(H+)=n(NaOH)=0.2mol,电荷守恒:n(Cl-)+2n(
)=n(BaCl2)=0.05mol,n(H+)=n(NaOH)=0.2mol,电荷守恒:n(Cl-)+2n(![]() )=n(H+),n(Cl-)=0.1mol,则原溶液中c(Cl-)=0.1mol/0.05L=2mol/L。
)=n(H+),n(Cl-)=0.1mol,则原溶液中c(Cl-)=0.1mol/0.05L=2mol/L。
(4)n(NH3)= =![]() ==
== ![]() ,m(NH3)=
,m(NH3)= ![]() ×17gmol-1=
×17gmol-1= ![]() ,溶液质量为
,溶液质量为![]() +1000g,溶液体积为[(
+1000g,溶液体积为[(![]() +1000)/ρ]mL,则所得溶液溶质物质的量浓度为1000ρv/(17v+22400)mol/L。
+1000)/ρ]mL,则所得溶液溶质物质的量浓度为1000ρv/(17v+22400)mol/L。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.230Th和232Th是钍的两种同素异形体
B.H2与T2互为同位素
C.甲醇与乙二醇互为同系物
D.乙酸乙酯与丁酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图所示.下列叙述正确的是( ) 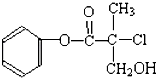
A.有机物A属于芳香烃
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1mol A和足量的NaOH溶液反应,可以消耗3mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、(1) 4.9gH3PO4的物质的量为____,其中含有____molH,含有______个O,含磷元素___g,若它可与6gNa0H完全反应生成正盐,则H3PO4为_____元酸。
(2)在9.5g某二价金属的氯化物中含有0.2molCl-,此氯化物的摩尔质量为____, 该金属元素为______。
II、有一包白色固体,可能含有CaCO3、Na2S04、KNO3、CuSO4、BaCl2五种物质中的一种或几种,现进行如下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
(3)取少量(2)中的溶液滴加Ba(NO3)2为溶液,有白色沉淀生成,加稀硝酸沉淀不溶。
根据上述实验现象判断:该白色固休中一定含有____,一定不含有____,可能含有_____。
III、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3, 2片小苏打片和胃酸完全中和,被中和的H+是___mol。
(2)胃舒平每片含0.234gAl(OH)3。写出胃舒平中和胃酸的离子反应方程式___, 中和胃酸时,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)写出上述实验过程中所用试剂:试剂①___________;试剂③___________。
(2)判断试剂①已过量的方法是:_______________________。
(3)操作①是利用半透膜进行分离提纯,操作①的实验结果:淀粉__________(填“能”或“不能”)透过半透膜;SO42-___________(填“能”或“不能”)透过半透膜。
(4)操作④的名称是________________。
(5)实验室用制得的NaCl晶体配制480mL1.0mol/L的NaCl溶液,用托盘天平称量的氯化钠固体的质量是___________,配制过程用到的玻璃仪器除量筒、烧杯、胶头滴管外,还有_____________。
(6)分析以下操作对配制的溶液浓度造成的影响,影响偏高的是____________________。
①蒸馏水洗完容量瓶后没有烘干
②转移溶液过程中出现漏液
③溶解后未经冷却就转移到容量瓶
④定容时俯视
⑤摇匀后发现液面降低,再加蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某化合物X受热分解:2X = A ↑+2B↑ + 4C↑,测得反应后生成的混合气体对H2的相对密度为12.则在相同条件下,X的相对分子质量是( )
A. 36B. 42C. 72D. 84
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的数值,下列说法中正确的是
表示阿伏加德罗常数的数值,下列说法中正确的是
A. 在常温常压下,11.2L氯气所含的原子数为![]()
B. 2.3g金属钠被氧化成Na2O2,转移电子数为0.1![]()
C. 5.6g铁与足量稀盐酸反应转移的电子数为0.3![]()
D. 2L 0.1 mol/LNa2SO4溶液中含有的Na+的数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com