
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_____________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于 ;
(3)P和Cl2分两步反应生成1 mol PCl5的反应热ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”或“等于”);
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________。
科目:高中化学 来源:2015-2016学年河北正定中学高二上学期第一次联考化学试卷(解析版) 题型:选择题
下列事实中一定不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④pH=1的CH3COOH溶液和pH=13的KOH溶液等体积混合,溶液呈酸性
⑤CH3COONa和稀H3PO4反应,生成CH3COOH
⑥pH=1的CH3COOH溶液稀释至100倍,pH<3
⑦10ml0.1mol.L-1CH3COOH恰好与10ml0.1mol.L-1NaOH溶液完全反应
A.②⑦ B.②⑤ C.①③⑤ D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届安徽省江南十校新高三摸底联考化学试卷(解析版) 题型:实验题
(12分)铝热反应是铝的一个重要性质。某校化学兴趣小组同学为了克服传统铝热反应纸漏
斗易燃烧,火星四射等缺点,将实验改成以下装置,取磁性氧化铁在如图A实验进行铝热反应,冷却后得到“铁块”混合物.

(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,共原因是 。
(2)该铝热反应的化学方程式为 。
(3)取反应后的“铁块”研碎取样称量,加入如图B装置,滴入足量NaOH溶液充分反应,测量生成气体体积以测量样品中残留铝的百分含量.试回答下列问题:
①量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为
②量气管在读数时必须进行的步骤是 。
③取1g样品进行上述实验,共收集到44.8mL气体(换算成标准状况下),则铝的百分含量为 。
④装置中分液漏斗上端和试管用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用。如果装置没有橡胶管,测出铝的百分含量将会 填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二开学考试化学试卷(解析版) 题型:选择题
原电池反应是释放能量的氧化还原反应,下列可设计成原电池的化学反应是
A.H2O (l)+CAO(s)=CA(OH)2(s)
B.BA(OH)2·8H2O+2NH4Cl=BACl2+2NH3·H2O+8H2O
C.2KClO3 2KCl+3O2↑
2KCl+3O2↑
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源:2016届天津一中高三零月考化学试卷(解析版) 题型:选择题
有关下列离子方程式的说法正确的是
A.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH-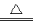 NH3↑+H2O
NH3↑+H2O
B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—
C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl—
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4— + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4===2CuI↓+13I2+12K2SO4+12H2O
其中1 mol氧化剂在反应中得到的电子为
A.10 mol B.11 mol C.12 mol D.13 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一入学摸底化学试卷(解析版) 题型:填空题
(8分)有一包白色固体混合物,该混合物可能含有CuSO4、Na2CO3、Na2SO4、MgCl2,现进行如下实验:
(1)将混合物溶于水,得到无色透明溶液。
(2)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解;另一份滴加NaOH溶液,有白色沉淀生成。试根据实验现象推断,并完成下面的填空:
该混合物中肯定没有________和________;肯定含有________和________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三9月月考化学试卷(解析版) 题型:实验题
(14分)铜在自然界存在于多种矿石中.
(Ⅰ)以硅孔雀石(主要成 分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
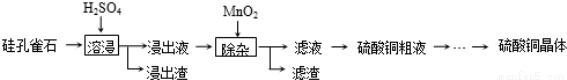
已知:Fe3+、Cu2+和Fe2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、6.7和9.7.
(1)“溶浸”中CuSiO3•2H2O和H2SO4发生反应的化学方程式 .
(2)“溶浸”中,选取浓度为20% H2SO4为浸出剂,铜的浸出率与浸出时间的关系见图1.由图1可得,随着浸出时间的增长, (至少写一条变化规律).

(3)“除杂”中,加入MnO2的作用是 (用离子方程式表示).“除杂”中需在搅拌下加入石灰乳以调节溶液的pH到3~4,沉淀部分杂质离子,分离得滤液.滤渣的主要成分为 .
(Ⅱ)以黄铜矿(主要成分为CuFeS2)为原料炼制精铜的工艺流程如下:
黄铜矿 精铜冰铜(Cu2S和FeS)
精铜冰铜(Cu2S和FeS) 粗铜
粗铜 精铜
精铜
(4)“还原”工艺中其中一个反应为:Cu2S+2Cu2O  6Cu+SO2↑,该反应的氧化剂是 .
6Cu+SO2↑,该反应的氧化剂是 .
(5)粗铜含少量Fe、Ag、Au等金属杂质,电解精炼铜时,阴极反应式为 .完成图2中由粗铜电解得到精铜 的示意图,并作相应标注.
的示意图,并作相应标注.

查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁葫芦岛一中高二上期初考试化学试卷 (解析版) 题型:填空题
(11分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
①此时体系的压强是开始时的 倍;
②若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为 反应(填“放热”或“吸热”);达新平衡时,容器内混合气体的平均分子量比原平衡时 (填增大、减小或相等)。
(4)此反应达平衡后,若只加大体系压强,Z的物质的量减少,若Y是气体,则X的聚集状态是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com