
 ��ͼΪһ���ȼ����صĻ����ṹ���õ���ܷ�ӦΪPbSO4+2LiCl+Ca�TCaCl2+Li2SO4+Pb����Ϊ����ʵ���ˮLiClKCl������������ں�ؼ���˲��������ܣ������й�˵����ȷ���ǣ�������
��ͼΪһ���ȼ����صĻ����ṹ���õ���ܷ�ӦΪPbSO4+2LiCl+Ca�TCaCl2+Li2SO4+Pb����Ϊ����ʵ���ˮLiClKCl������������ں�ؼ���˲��������ܣ������й�˵����ȷ���ǣ�������| A��������Ӧʽ��Ca+2Cl-+2e-�TCaCl2 |
| B���ŵ�����У�Li+���ƶ� |
| C��ÿת��0.1mol���ӣ�����������20.7gPb |
| D������ʱ��������������ϵ�����������ƣ�ָ�벻ƫת |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
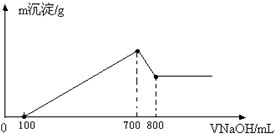 ��ij������þ���Ͻ��ܽ���500mL�����У���Ӧ�����Һ����μ���2mol/L NaOH��Һ�������������������Һ����Ĺ�ϵ��ͼ��ʾ����
��ij������þ���Ͻ��ܽ���500mL�����У���Ӧ�����Һ����μ���2mol/L NaOH��Һ�������������������Һ����Ĺ�ϵ��ͼ��ʾ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ƽ��ʱ��������NH3��g��������������������е�С | ||
B��ƽ��ʱ�������������ѹǿΪ��ʼʱѹǿ��
| ||
| C���ﵽƽ��ʱ����������H2��ת����Ϊ25% | ||
D��Q1=
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��v����������v���棩��С��ƽ��������Ӧ�����ƶ���ƽ��ʱSO3�İٷֺ������� |
| B��v����������v���棩���䣬ƽ��������Ӧ�����ƶ���ƽ��ʱSO3�İٷֺ������� |
| C��v������ ��С��v���棩����ƽ��������Ӧ�����ƶ���ƽ��ʱSO3�İٷֺ������� |
| D����ʼʱv����������ƽ��������Ӧ�����ƶ���ƽ��ʱSO3�İٷֺ������ֲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/L |
| B��0.5 mol/L |
| C��0.01mol/L |
| D��0.05 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��10gH2 �� 10g O2 |
| B��11.2L N2 ����״���� �� 11g CO2�ķ����� |
| C��9g H2O ��0.5mol Br2 |
| D��224ml H2 ����״���� ��0.1 mol N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ȼ��ⲻ�ֽ� |
| B��Һ̬�Ȼ��ⲻ���� |
| C���Ȼ�������ˮ�������� |
| D���Ȼ���ˮ��Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
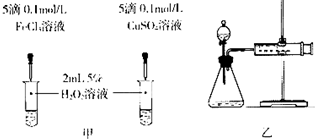
| ��� | ���� | ʵ������ |
| �� | �ֱ����Թ�A��B�м���5mL 5% H2O2��Һ��������2��1mol/L FeCl3��Һ�����Թ��о����������ݳ���ʱ�����Թ�A����ʢ��5��������ˮ���ձ��н��ݣ����Թ�B����ʢ��40��������ˮ���ձ��н��ݣ� | �Թ�A�в��ٲ������ݣ� �Թ�B�в��������������� |
| �� | ��ȡ��֧�Թֱܷ����5mL 5% H2O2��Һ��5mL 10% H2O2��Һ | �Թ�A��B�о�δ���Լ����� ���ݲ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com