
将8克SO3加入X克水中,所形成的溶液里SO42﹣和水分子个数比为1:5,则X等于( )
A. 9克 B. 10.8克 C. 12.4克 D. 15.6克
考点: 物质的量的相关计算.
分析: 根据n=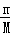 计算SO3的物质的量,根据SO3+H2O=H2SO4计算反应消耗水的物质的量、生成硫酸物质的量,再计算形成的溶液中水的物质的量,进而计算水的总物质的量,根据m=nM计算水的质量.
计算SO3的物质的量,根据SO3+H2O=H2SO4计算反应消耗水的物质的量、生成硫酸物质的量,再计算形成的溶液中水的物质的量,进而计算水的总物质的量,根据m=nM计算水的质量.
解答: 解:8gSO3的物质的量为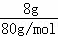 =0.1mol,
=0.1mol,
SO3+H2O=H2SO4
0.1mol 0.1mol 0.1mol
形成的溶液中SO42﹣和水分子的个数比为1:5,则溶液中水的物质的量为0.1mol×5=0.5mol,
故水的总质量为(0.5mol+0.1mol)×18g/mol=10.8g,
故选B.
点评: 本题考查物质的量有关计算,难度不大,属于易错题目,学生容易忽略参加反应水的质量.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
下列说法中正确的是()
A. 钠的化学性质很活泼,在自然界里不能以游离态存在
B. 化学的特征就是认识分子
C. 在化学反应中,参加反应的各物质的质量比等于其物质的量之比
D. 俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的 基础
基础
查看答案和解析>>
科目:高中化学 来源: 题型:
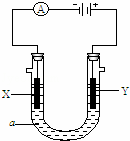
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是 .在X极附近观察到的是 .
②Y电极上的电极反应式是 ,检验该电极反应产物的方法是 .
(2)如要用电解方法实现将铁片镀上一层金属铜,电解液a选用CuSO4溶液,则
①X电极的材料是Fe②Y电极反应式是 .
③已知开始时铁片与铜片的质量相同,当电路中有0.4摩尔电子通过时,两极质量相差 克.
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色.下列有关推断正确的是( )
A. 简单离子半径:Y>Z>W>Q>X
B. W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1:2
C. X能分别与Y、Z、W形成共价化合物
D. Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
可确认发生了化学平衡移动的是()
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)⇌nZ(g)+2W(g).5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/L•min,则n的值为()
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
多硫化钙[CaSx( x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得.不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙.
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
(1)硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x=4.
(2)取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解.原理如下:Sx2﹣+2H2O+2CO2→(x﹣1)S↓+H2S↑+2HCO3﹣;S2O32﹣+H2O+CO2→HSO3﹣+HCO3﹣+S↓
完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 .(答案用小数表示,保留2位有效数字)
(3)如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 .
(4)现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙.请推算这二种多硫化钙可能的物质的量之比 (写出推理过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com