
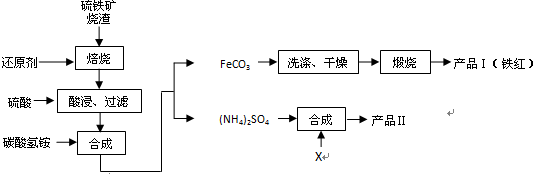
分析 Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤时用到的仪器有铁架台、漏斗、烧杯、玻璃棒等,所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵,实验室进行煅烧操作所需仪器有酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳;碳酸亚铁与氧气反应生成了氧化铁和二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,以此解答该题,
(1)若焙烧时还原剂碳燃烧产生的气体为CO,与氧化铁反应生成铁和二氧化碳气体;
(2)溶液中Fe2+具有还原性,可被空气中氧气氧化含量将下降;
(3)碳酸氢铵不稳定,加热易分解;
(4)流程图可以看出酸浸、过滤后滤液中的溶质主要是硫酸亚铁,硫酸亚铁和碳酸氢铵反应生成碳酸亚铁和硫酸铵,过滤后反应Ⅱ中硫酸铵与X反应生成硫酸钾和氯化铵,因此加入的X应为氯化钾,过滤得到硫酸钾,说明硫酸钾溶解度小;
(5)碳酸亚铁与氧气反应生成了氧化铁和二氧化碳;
(6)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-.
解答 解:(1)若焙烧时还原剂碳燃烧产生的气体为CO,与氧化铁反应生成铁和二氧化碳气体,方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)具有还原性,可被空气中氧气氧化,方程式为4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)碳酸氢铵不稳定,加热易分解,应在温度较低的情况下加热,
故答案为:防止碳酸氢铵分解;
(4)由流程图可以看出酸浸、过滤后滤液中的溶质主要是硫酸亚铁,硫酸亚铁和碳酸氢铵反应生成碳酸亚铁和硫酸铵,过滤后反应Ⅱ中硫酸铵与X反应生成硫酸钾和氯化铵,因此加入的X应为氯化钾,要过滤得到硫酸钾,说明在此条件下硫酸钾的溶解度小于氯化铵的溶解度,反应的离子方程式为:2K++SO42-=K2SO4↓,
故答案为:KCl;2K++SO42-=K2SO4↓;
(5)碳酸亚铁与氧气反应生成了氧化铁和二氧化碳,4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(6)因检验产品II中是否含有氯化物杂质需先除去SO4,再检验Cl-,所以滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液,
故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液.
点评 本题综合考查物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的目的和原理,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲、乙中都是铝过量 | B. | 甲中铝过量,乙中碱过量 | ||
| C. | 甲中酸过量,乙中铝过量 | D. | 甲、乙中都是铝不足 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.  ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.
l,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.189cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可用下列反应制备1,2二溴乙烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 不变 D.溶液中
不变 D.溶液中 减小
减小| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com