
【题目】下列固体溶于水时吸热的是
A. 氯化铵 B. 氢氧化钠 C. 氧化钙 D. 过氧化钠
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 己知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol,则H2的标准燃烧热为-241.8 kJ/mol
B. 已知C(石墨,s)==C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热置,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
D. 已知 2SO2(g)+O2(g) ![]() 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g)和lOmol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下

(1)贝壳的主要化学成分为______(写化学式);
(2)写出反应②的离子方程式:__________________________________________。
(3)根据流程图可知 可循环利用的物质是______________________________。
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成。请写出Mg与CO2反应的化学方程式并标出电子转移的方向与数目:____________________________________________________。
(5)Na比Mg和Al要活泼,将Na投入到 Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料,以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
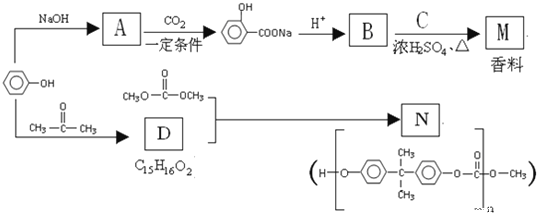
(1)有机物B的名称是_________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种.C的结构简式是___________.
(3)B与C反应的反应类型是________由D生成N的反应类型是________。
(4)由苯酚生成D的化学方程式是_____________。
(5)F是分子量比B大14的同系物,则F的分子式是_________,F有多种同分异构体,符合下列条件的同分异构体有_____种。
①属于芳香族化合物;
②遇FeCl3溶液显紫色,且能发生水解反应;
③苯环上有两个取代基,且苯环上的一溴代物只有两种。
(6)已知: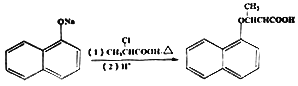 ,写出以苯酚、乙醇和CH2ClCOOH为原料制备
,写出以苯酚、乙醇和CH2ClCOOH为原料制备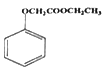 的合成路线流程图(无机试剂任用)。_____
的合成路线流程图(无机试剂任用)。_____
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D. 烧杯中铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,环境问题越来越引起人们的重视。温室效应、酸雨、臭氧层被破坏、赤潮等已经给我们赖以生存的环境带来较大的影响,造成酸雨的主要有害物质是
A. CO2B. 硫和氮的氧化物
C. 含氟化合物D. 化肥和含磷洗衣粉的使用及其污水的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素。A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol·L-1D溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是( )

A. X、Y、Z元素的离子半径大小是X>Y>Z
B. X元素的氢化物沸点比同主族元素的氢化物低
C. Y与Q和W与Q元素形成的化合物化学键类型相同
D. Q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3,如下图所示。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是____________。
(2)II中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如下图)。

①比较P1、P2的大小关系:P1______P2(用“>”、“<”、“=”)
②随温度升高,该反应平衡常数变化的趋势是________。
(3)III中,将NO2、O2、H2O化合制硝酸的化学方程式_______。
(4)IV中,电解NO制备 NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1HA溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法错误的是

A. HA的电离方程式为HA![]() H++A-
H++A-
B. HA完全反应时,溶液所对应的点位于c和d之间
C. 滴定到c点时:c(Na+)>c(A-)>c(H+)=c(OH-)
D. 滴定到d点时:n(Na+)+n(H+)-n(OH-)+n(HA)=0.002mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com