
| A. | NaOH | B. | Na2O | C. | Na | D. | CaO |
分析 NaOH可吸水潮解;Na2O可与水反应:Na2O+H2O=2NaOH;钠可与水反应:2Na+2H2O=2NaOH+H2↑;CaO可吸水:CaO+H2O=Ca(OH)2,根据发生的反应中,存在元素的化合价变化,则因发生氧化还原反应而变质,以此来解答.
解答 解:A.潮解后与空气中的二氧化碳反应生成碳酸钠,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.与水反应生成NaOH,或与二氧化碳反应生成碳酸钠,均没有元素的化合价变化,不发生氧化还原反应,故B不选;
C.被氧化氧化,Na、O元素的化合价变化,因发生氧化还原反应而变质,故C选;
D、CaO+H2O=Ca(OH)2,是非氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,注意从元素化合价角度分析,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 1mol Cu分别与足量的Cl2和S反应,转移电子数均为2NA | |
| D. | 1mol•L-1 FeCl3溶液中含有的Fe3+数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
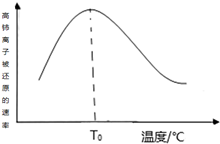 高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.
高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
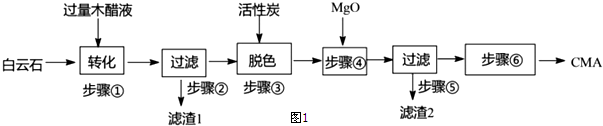

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
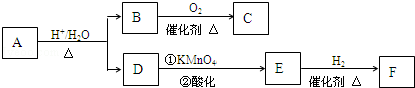
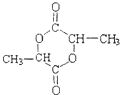 .
.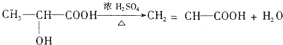 .
.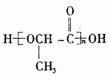 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油中绝不含铅元素 | B. | 汽油中不人为添加含铅元素的物质 | ||
| C. | 汽油中含铅元素在一定指标范围内 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
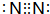 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在Na2CO3溶液中一定有:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| B. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 在NH4Cl溶液中一定有:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 在CH3COONa溶液中一定有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com