
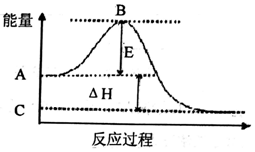
分析 (1)①E为活化能,活化能的大小与反应热无关;
②根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)①根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
②若1mol水蒸气转化为液态水放热45kJ,即H2O(g)=H2O(l)△H=-45kJ/mol,
根据盖斯定律计算生成液态水的反应热.
解答 解:(1)①E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,故答案为:无;
②因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,故答案为:-198;
(2):①:氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;
②若1mol水蒸气转化为液态水放热45kJ,即H2O(g)=H2O(l)△H=-45kJ/mol,
i.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
ii.H2O(g)=H2O(l)△H=-45kJ/mol
i+ii得H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286.8kJ/mol
故答案为:-286.8.
点评 本题考查反应热的有关计算,为高频考点,侧重考查学生分析计算能力,明确基本概念、热化学方程式书写规则、盖斯定律是解本题关键,熟练掌握盖斯定律并灵活运用,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 原子总数是4NA的N2与CO混合物,其质量是56g | |
| C. | Na2O2和KMnO4分别制得1molO2,转移的电子数均是2NA | |
| D. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1 molO2参加反应时,转移电子的物质的量为4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L 的 H2SO4溶液 PH=1 | |
| B. | 0.001mol/L 的 NaOH溶液 PH=11 | |
| C. | 0.005mol/L的H2SO4溶液与0.0lmol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 | |
| D. | 完全中和PH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | (NH4) 2Fe (SO4) 2溶液与过量NaOH 溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向 NaAlO2溶液中通过里 CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性 KMnO4 氧化 H2O2:MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备单晶硅的过程中不发生氧化还原反应 | |
| B. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 氢氧化铝可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果△H偏小 | |
| B. | 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化 | |
| C. | 滴定管在装标准溶液前,必须先用待装标准溶液润洗 | |
| D. | NaHCO3溶液和稀盐酸可以用互滴的方法鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
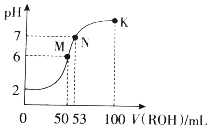 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )| A. | ROH为一元弱碱 | |
| B. | M点溶液呈酸性的原因是R++H2O?ROH+H+ | |
| C. | M、N、K三点水的电离程度逐渐减小 | |
| D. | K点溶液中离子浓度c(Cl-)>c(R+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com