
【题目】常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示.下列说法正确的是( ) 
A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3﹣)>c(NH3H2O)>c(CO32﹣)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3H2O)+c(H+)=c(OH﹣)+2c(CO32﹣)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3﹣浓度逐渐减小
D.通过分析可知常温下Kb(NH3H2O)>Ka1(H2CO3)
【答案】D
【解析】解:A.结合图象可知,溶液的pH=9时,溶液中离子浓度大小为:c(HCO3﹣)>c(NH4+)>c(NH3H2O)>c(CO32﹣),故A错误; B.NH4HCO3溶液中存在物料守恒:c(NH4+)+c(NH3H2O)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),由于碳酸氢根离子的水解程度较小,则c(NH4+)+c(NH3H2O)+c(H+)>c(OH﹣)+2c(CO32﹣)+c(H2CO3),故B错误;
C.0.1mol/L的NH4HCO3溶液的pH=7.8,根据图象可知,当溶液pH增大时,铵根离子浓度逐渐减小,而碳酸氢根离子能够先增大后减小,故C错误;
D.由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则一水合氨的电离平衡常数大于Ka1(H2CO3),故D正确;
故选D.
A.当pH=9时,结合图象判断溶液中各离子浓度大小;
B.根据碳酸氢铵溶液中的物料守恒分析;
C.该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3﹣浓度变化;
D.碳酸氢铵溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】按要求填空.
(1)实验室通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式是 . 如有1molCl2生成,被氧化的HCl的物质的量是mol.
(2)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的离子方程式为;
(3)氢氧化亚铁被空气里氧气氧化,反应的化学方程式为 .
(4)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2 , 会出现软而透明的凝胶胶体,同时得到一种钠盐.写出该钠盐的化学式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.请回答:
(1)实验室制取氨气的化学方程式是 .
(2)该小组同学设计了如图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物. 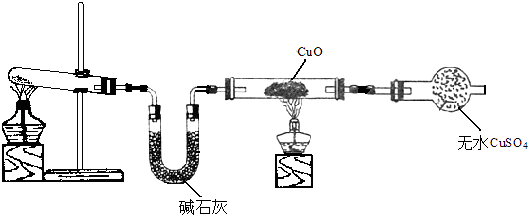
①实验现象为:黑色CuO变为红色;白色水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式 .
②碱石灰的作用是 .
(3)有同学认为:NH3与CuO反应的红色产物中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu2O+2H+=Cu+Cu2++2H2O).探究实验中取小许红色物质于试管中,加入 , 若溶液中出现 , 则说明含有Cu2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水只作氧化剂的是( )
A.2F2+2H2O═4HF+O2
B.2Na+2H2O═2NaOH+H2↑
C.CaO+H2O═Ca(OH)2
D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向AgNO3溶液中加入Cu粉:Cu+Ag+═Cu2++2Ag
B.向CaCl2溶液中通入CO2:Ca2++CO2═CaCO3↓+2H+
C.饱和FeCl溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体、离子晶体、分子晶体采取密堆积方式的原因是( )
A.构成晶体的微粒均可视为圆球
B.三种晶体的构成微粒相同
C.金属键、离子键、范德华力均无饱和性和方向性
D.三种晶体构成微粒的多少及相互作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯和苯甲酸铜. (一)制备苯甲酸乙酯![]() +C2H5OH
+C2H5OH ![]()
![]() +H2O
+H2O
相关物质的部分物理性质如上表格:
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
达到平衡所需要时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化剂 | |
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 , 反应液中的环己烷在本实验中的作用 . 
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.反应完成的标志是 .
(3)步骤③碳酸钠的作用是 , 碳酸钠固体需搅拌下分批加入的原因 .
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用 .
(5)步骤⑤蒸馏操作中,下列装置最好的是(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用(水浴加热、直接加热、油浴加热). 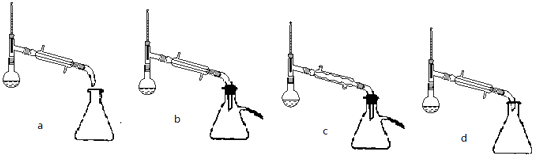
(6)(二)制备苯甲酸铜 将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品.
混合溶剂中乙醇的作用是 , 趁热过滤的原因
(7)本实验中下列药品不能代替氢氧化铜使用的是
A.醋酸铜
B.氧化铜
C.碱式碳酸铜
D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属键的实质是( )
A.自由电子与金属阳离子之间的相互作用
B.金属原子与金属原子间的相互作用
C.金属阳离子与阴离子的吸引力
D.自由电子与金属原子之间的相互作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com