
【题目】环境监测测定水中溶解氧的方法是:①量取25.00mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用0.1000mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O32-=2I-+S4O62-
滴定次数 | 待测液的体积/mL | 0.1000mol·L-1 Na2S2O3的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
试回答:
(1)消耗Na2S2O3的体积平均值为___mL,水中溶解氧的量是(以g/L为单位,保留3位有效数字)___。
(2)滴定(I2和S2O32-反应)以淀粉溶液为指示剂,终点时现象为___。
(3)判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视___。
②未用标准液润洗滴定管___。
③配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质___。
④待测液的滴定管之前有气泡,取液后无气泡___。
【答案】26.10 0.835 由蓝色变为无色,且半分钟内不变色 偏小 偏大 偏大 偏小
【解析】
(1)第二组数据误差较大,舍去后,根据其余两组数据计算体积平均值,再根据O2~2MnO(OH)2~2I2~4S2O32-计算水中溶解氧的量;
(2)碘遇淀粉变成蓝色,若碘被还原完,则蓝色褪去;
(3)分析不当操作对标准溶液体积的影响,以此判断浓度的误差。
(1)第二组数据误差较大,舍去,根据其余两组数据计算出体积的平均值=![]() =26.10mL;
=26.10mL;
根据反应2Mn2++O2+4OH-=2MnO(OH)2、MnO(OH)2+2I-+4H+=Mn2++I2+3H2O和I2+2S2O32-=2I-+S4O62-可得关系式:
O2 ~ 2MnO(OH)2 ~ 2I2 ~ 4S2O32-
32g 4mol
m 0.1000mol/L×26.10mL×10-3L/mL
m=![]() =20.88×10-3g,则1L水样中溶解氧的量为
=20.88×10-3g,则1L水样中溶解氧的量为![]() =0.835g/L;
=0.835g/L;
(2)碘遇淀粉变成蓝色,若碘被还原完,则蓝色褪去,且半分钟不恢复蓝色,可证明达到了滴定终点;
(3)①滴定前平视,滴定后俯视则所用标准液读数偏小,计算结果偏小;
②滴定前,未用标准液润洗滴定管,则消耗的标准液的体积偏大,测得的待测液浓度偏大;
③配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质,所用标准液体积偏大,计算结果偏大;
④待测液的滴定管之前有气泡,取液后无气泡,所取待测液体积偏小,计算结果偏小。


科目:高中化学 来源: 题型:
【题目】有机物Z是一种天然除草剂,可由X、Y在一定条件下反应制得。下列说法正确的是( )
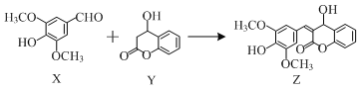
A.有机物X最多可与3molH2发生加成反应
B.可用FeCl3溶液鉴别X和Y
C.Y在Cu作催化剂条件下可被氧化为含醛基的物质
D.X与Y只通过加成反应即可生成Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________________。
(2)H2S燃烧生成的SO2与H2S进一步反应,硫元素转化为S2,写出反应的化学方程式:__________________________。
(3)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
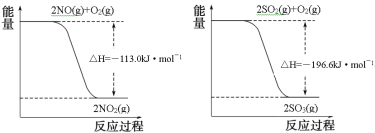
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15molSO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
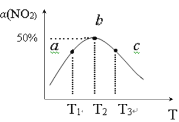
①a、c两点反应速率大小关系:υ(a)___υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为___,此温度下该反应的平衡常数为___,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30molSO2,NO2的转化率___。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:___。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
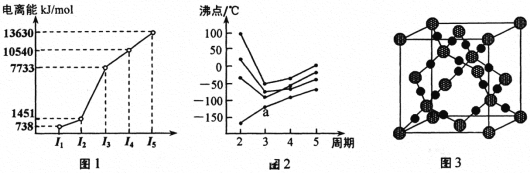
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
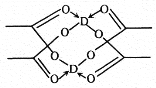
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

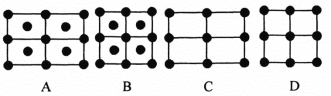
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700900℃时,O2可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
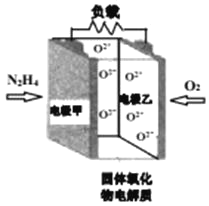
A.电池内的O2由电极乙移向电极甲
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有lmolN2H4消耗时,乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应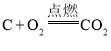 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 ![]() 部分生成物和反应条件略去
部分生成物和反应条件略去![]() 。下列推断不正确的是
。下列推断不正确的是![]()
![]()
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是![]()
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com