
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列设计的实验方案能达到实验目的的是
A.用右图装置可以制备沉淀Fe(OH)2
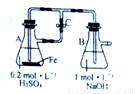
B.提纯含有少量KNO3的NaCl:溶于水,蒸发浓缩、冷却结晶,过滤洗涤干燥
C.检验(NH4)2FeSO4晶体中的NH4+:取样品于试管中溶于水,滴加足量NaOH溶液,加热,将湿润的蓝色石蕊试纸放在试管口,观察试纸是否变红色
D.探究CO2、H2O与Na2O2反应是放热反应:用洁净的玻璃管向包有Na2O2的脱脂棉吹气,观察脱脂棉燃烧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:填空题
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在485℃时,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应合成甲醇:
(1)请完成CO2和3mol H2反应合成甲醇的热化学方程式:
CO2(g)+3H2(g)  CH3OH(g)+______( ),△H=-49.0kJ/mol
CH3OH(g)+______( ),△H=-49.0kJ/mol
(2)测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= ___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③据图中提供的数据计算在该温度下的K值。要有计算过程。(保留三位有效数字)
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)
A.容器中压强不变的状态 B.混合气体中c(CO2)不变的状态
C.V逆(H2O)=3 V正 (H2) D.混合气体的密度保持不变的状态
E.用CO2、H2、CH3OH的物质的量浓度变化表示的反应速率的比为1:3:1的状态
F.混合气体的平均相对分子质量不再改变的状态
(4)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:填空题
HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀HNO3充分反应,反应过程中无任何气放出。在反应结束后的溶液中,逐渐加入4 mol·L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如下图。请回答:
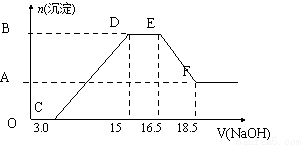

(1)与HNO3反应后Fe元素的化合价是_____________
(2)纵坐标中A点数值是______________,B点数值是____________,原HNO3浓度是______________
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三上第四次月考理综化学试卷(解析版) 题型:选择题
下表中实验操作、现象和所得出的结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
B | 向氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
C | 碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液 | 产生白色沉淀 | X可能是NaHCO3 |
D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y一定是Cl2 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上12月段考化学试卷(解析版) 题型:填空题
煤气化和液化是现代能源工业中重点考虑的能量综合利用方案。最常见的气化方法为用煤生成水煤气,而当前比较流行的液化方法用煤生成CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则反应CO(g) +2H2(g)=CH3OH(g) 的△H=_______。
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
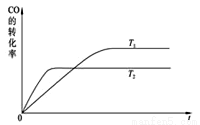
①T1和T2温度下平衡常数大小关系是K1____K2(填“>”“<”或“=”)。
②由CO合成甲醇时,CO在250℃、300℃、350℃下达到平衡时转化率与压强的关系曲线如下图所示,则曲线c所表示的温度为______℃,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______。
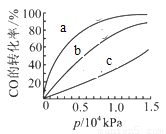
③以下有关该反应的说法正确的是_________(填序号)。
A.恒温、恒容条件下同,若容器内的压强不发生变化,则可逆反应达到平衡
B.一定条件下,H2的消耗速率是CO的消耗速率的2倍时,可逆反应达到平衡
C.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产率
D.某温度下,将2molCO和6molH2充入2L密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%
(3)一定温度下,向2L固定体积的密闭容器中加入1molCH3OH,发生反应:CH3OH(g)  CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g) +2H2(g),H2的物质的量随时间变化的曲线如图所示。
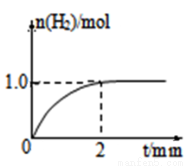
0~2min内的平均反应速率v(CH3OH)= ____________;该温度下,CO(g)+2H2(g) CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
CH3OH(g)的平衡常数K=____________;相同温度下,若开始加入CH3OH(g)的物质的量是原来的2倍,则_____ 是原来的2倍.
A.平衡常数 B.CH3OH的平衡浓度 C.达到平衡的时间 D.平衡时气体的密度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:推断题
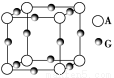
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1 ℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一12月月考化学试卷(解析版) 题型:选择题
铁和氧化铁的混合物共amol,加盐酸后固体全部溶解,共收集到2bgH2,且溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
A.b mol B.(a-b)mol C.1/2(a?b)mol D.1/2(a+b)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com