
 某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).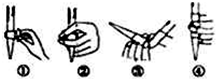
分析 (1)根据仪器的特征和用途分析;
(2)恒压滴液漏斗代替分液漏斗可以平衡内外压强,使盐酸顺利滴下;
(3)从质量守恒、电荷守恒和电子守恒的角度配平方程式;Cr2+在溶液中为蓝色,据此确定反应完成的标志;
(4)洗涤产品最好选用有机溶剂易挥发易干燥,且溶解度小;
(5)根据铬守恒计算出1.47g K2Cr2O7 粉末的理论产品质量,结合产率=$\frac{实际质量}{理论质量}$×100%计算;
(6)①锡与盐酸发生反应:Sn+2HCl═SnCl2+H2↑;SnCl2与氯化铁反应生成SnCl4和FeCl2;
②K2Cr2O7溶液具有强氧化性,可氧化腐蚀橡胶,滴定时发生反应:6Fe2++Cr2O72-+14H+═6Fe3++2 Cr3++7 H2O,根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,根据n=cV计算反应中消耗的K2Cr2O7的物质的量,根据关系式计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
(7)依据碱式滴定管的使用方法分析判断,滴定前发现滴定管尖嘴处有少量气泡,排出气泡的正确操作是③.
解答 解:(1)上图装置中,A仪器有三个口,可以同时加入多种反应物,且连接冷凝管,为三颈烧瓶,
故答案为:三颈烧瓶;
(2)①和普通分液漏斗相比,恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,
故答案为:平衡气压或平衡压强;
(3)锌和重铬酸根离子反应,反应中Cr元素化合价由+6价降低到+3价,Zn元素化合价由0价升高到+2价,则最小公倍数为6,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为Cr2O72-+3Zn+14H+?2Cr3++3Zn2++7H2O,反应完成的标志是溶液变为蓝色,
故答案为:Cr2O72-+3Zn+14H+?2Cr3++3Zn2++7H2O;溶液变为蓝色;
(4)洗涤产品时,最好选用无水乙醇,减小产品的损耗,同时因乙醇易挥发,易于干燥,
故答案为:b;
(5)1.47g K2Cr2O7 粉末的物质的量为$\frac{1.49g}{294g/mol}$=0.005mol,根据铬守恒,理论生成无水醋酸亚铬(Cr(CH3COO)2)产品质量为0.005mol×2×170g/mol=1.7g,最后获得的无水醋酸亚铬产品质量为 1.38g,则产品的产率为$\frac{1.38g}{1.7g}$×100%≈81.18%,
故答案为:81.18;
(6)①锡与盐酸发生反应:Sn+2HCl═SnCl2+H2↑,加入过量的FeCl3溶液,发生的反应为:SnCl2+2FeCl3═SnCl4+2FeCl2,
故答案为:SnCl2+2FeCl3=SnCl4+2FeCl2;
②K2Cr2O7溶液具有强氧化性,可氧化腐蚀橡胶,则K2Cr2O7溶液应装在酸式滴定管中,滴定时发生反应:6 Fe2++Cr2O72-+14 H+═6 Fe3++2 Cr3++7 H2O,根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,反应中消耗的K2Cr2O7的物质的量为Cmol/L×V×10-3L,故n(Sn)=3n(K2Cr2O7)=3×Cmol/L×V×10-3L=3CV×10-3mol,
Sn的质量为:3CV×10-3mol×Mg/mol=3×10-3CVMg,样品中锡的质量分数为:$\frac{3.0×1{0}^{-3}CVM}{ω}×100%$,
故答案为:酸式; $\frac{3.0×1{0}^{-3}CVM}{ω}×100%$;
(7)用KOH滴定某溶液,滴定选择碱式滴定管,图2中①、②都为酸式滴定管,滴定前发现滴定管尖嘴处有少量气泡,排出气泡的正确操作是将橡皮管稍向上弯曲,挤压玻璃球,气泡可被流水挤出,即选③,
故答案为:③.
点评 本题主要考查醋酸亚铬的制取、氧化还原、滴定计算等知识点,题目难度中等,为高考的高频题,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 的物质的量浓度为0.5mol•L-1 | |
| B. | Cl-的个数为3.01×1023 | |
| C. | Mg2+的物质的量为2mol | |
| D. | Cl-的物质的量浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2+3Mg$\frac{\underline{\;点燃\;}}{\;}$Mg3N2 | B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫离子:${\;}_{16}^{32}$S2- | |
| B. | S2-的结构示意图: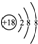 | |
| C. | Na2O2的电子式:Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+ | |
| D. | 亚硫酸的电离方程式:H2SO3?2H++SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
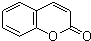
 )和某合成鞣剂(
)和某合成鞣剂( 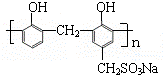 )
)

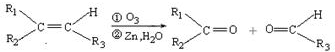 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)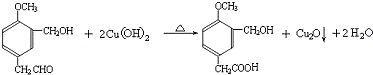 .
. .
.
 ,写出 X可能的结构简式为
,写出 X可能的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中CH3COO-和Na+的数目 | |
| B. | 纯水在80℃和25℃时的pH | |
| C. | 相同温度下,100mL0.01mol•L-1醋酸与10mL0.1mol•L-1醋酸中H+的物质的量 | |
| D. | 相同温度下,pH=12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com