
分析 根据n=$\frac{m}{M}$计算各气体的物质的量,再根据$\overline{M}$=$\frac{m总}{n总}$计算平均摩尔质量,相同条件下气体密度之比等于其摩尔质量之比,气体物质的量除以混合气体总物质的量件数物质的量分数,据此计算解答.
解答 解:5.6gCO物质的量=$\frac{5.6g}{28g/mol}$=0.2mol、4.4gCO2物质的量=$\frac{4.4g}{44g/mol}$=0.1mol,0.4gH2物质的量=$\frac{0.4g}{2g/mol}$=0.2mol,组成的混合气体总质量=5.6g+4.4g+0.4g=10.4g,总物质的量n=0.2mol+0.1mol+0.2mol=0.5mol,混合气体的平均摩尔质量$\overline{M}$=$\frac{10.4g}{0.5mol}$=20.8g/mol,
相同条件下气体密度之比等于其摩尔质量之比,混合气体对O2的相对密度=$\frac{20.8g/mol}{32g/mol}$=0.65,
混合气体中含CO的物质的量分数=$\frac{0.2mol}{0.5mol}$×100%=40%,
答:混合气体的平均摩尔质量20.8g/mol,混合气体对O2的相对密度0.65,混合气体中含CO的物质的量分数40%.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及其推论,题目难度不大,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| C | 测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与稀盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.4g | C. | 8.8g | D. | 4.4~8.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
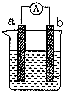 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P4和NO2都是共价化合物 | |
| B. | 在CO2和SiO2晶体中都存在分子间作用力 | |
| C. | CCl4和NH3分子中都含有极性键 | |
| D. | Na2O2是离子化合物,只含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com