
【题目】(1) 一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入0.1 molCH3COONa固体,溶液中![]() __________________(填“增大”、“减小”或“不变”)。
__________________(填“增大”、“减小”或“不变”)。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”、“<”或“=”),而溶液中 c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= _________mol·L-1。
(3)常温下,向20 ml 0.1mol·L-1 Na2CO3溶液中逐滴加入0.1mol·L-1 HC1溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下图,回答下列问题:

①若将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是________________;
为测定Na2CO3和NaHCO3混合物中的质量分数,下列方案可行的是_________________
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
②所得溶液中含量最多的三种离子的物质的量浓度的大小关系为_________________
【答案】 不变 < c(Na+) = c(CH3COO-) > c(H+) = c(OH-) 1/30或0.033 8<pH<12 ABD c(Na+)=c(Cl-)>c(HCO3-)
【解析】试题分析:(1) 醋酸的电离平衡常数K=![]() ,因为平衡常数只与温度有关,温度不变,平衡常数不变,所以溶液中加入醋酸钠,K不变;(2)① 若氢氧化钠和醋酸等体积混合,溶液为醋酸钠溶液,显碱性,所以要显中性,碱要少些,选<,因为溶液为中性,即氢离子浓度和氢氧根离子浓度相等,则根据电荷守恒可以知道,另外的阴阳离子浓度也相等,所以有c(Na+) = c(CH3COO-) > c(H+) = c(OH-) ② 根据电荷守恒分析有c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),根据物料守恒有c(Na+) = 2c(CH3COO-)+ 2c(CH3COOH),两个关系式相减,消除醋酸根离子浓度,即可得:c(OH-) -c(H+) - c(CH3COOH)=1/2c(Na+) ,钠离子浓度为0.1×0.04/0.06=1/30或0.033mol/L。(3)①从图分析,碳酸钠和碳酸氢钠共存时溶液的pH为8<pH<12;A、碳酸氢钠受热分解质量减少部分为二氧化碳和水的质量,根据减少的质量就能计算碳酸氢钠的质量,进而计算质量分数;B、二者都和盐酸反应生成氯化钠,根据方程式可以计算碳酸钠的质量分数;C、和硫酸反应生成二氧化碳和水,二氧化碳和水都可以被碱石灰吸收,因为水蒸气可以是从溶液中带出的,不能确定其质量,所以不能进行计算;D、二者都可以和氢氧化钡反应生成碳酸钡沉淀,通过碳酸钡的质量和混合物的质量能计算碳酸钠的质量分数,所以选ABD。②碳酸钠的物质的两位0.10×0.02=0.002摩尔,氯化氢的物质的量为0.1×0.04=0.004摩尔,其中钠离子和氯离子物质的量相等,二者反应生成氯化钠和二氧化碳和水,二氧化碳溶解在水中形成饱和溶液,含有碳酸电离出的碳酸氢根离子,所以含量最多的三种离子的浓度关系为c(Na+)=c(Cl-)>c(HCO3-)。
,因为平衡常数只与温度有关,温度不变,平衡常数不变,所以溶液中加入醋酸钠,K不变;(2)① 若氢氧化钠和醋酸等体积混合,溶液为醋酸钠溶液,显碱性,所以要显中性,碱要少些,选<,因为溶液为中性,即氢离子浓度和氢氧根离子浓度相等,则根据电荷守恒可以知道,另外的阴阳离子浓度也相等,所以有c(Na+) = c(CH3COO-) > c(H+) = c(OH-) ② 根据电荷守恒分析有c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),根据物料守恒有c(Na+) = 2c(CH3COO-)+ 2c(CH3COOH),两个关系式相减,消除醋酸根离子浓度,即可得:c(OH-) -c(H+) - c(CH3COOH)=1/2c(Na+) ,钠离子浓度为0.1×0.04/0.06=1/30或0.033mol/L。(3)①从图分析,碳酸钠和碳酸氢钠共存时溶液的pH为8<pH<12;A、碳酸氢钠受热分解质量减少部分为二氧化碳和水的质量,根据减少的质量就能计算碳酸氢钠的质量,进而计算质量分数;B、二者都和盐酸反应生成氯化钠,根据方程式可以计算碳酸钠的质量分数;C、和硫酸反应生成二氧化碳和水,二氧化碳和水都可以被碱石灰吸收,因为水蒸气可以是从溶液中带出的,不能确定其质量,所以不能进行计算;D、二者都可以和氢氧化钡反应生成碳酸钡沉淀,通过碳酸钡的质量和混合物的质量能计算碳酸钠的质量分数,所以选ABD。②碳酸钠的物质的两位0.10×0.02=0.002摩尔,氯化氢的物质的量为0.1×0.04=0.004摩尔,其中钠离子和氯离子物质的量相等,二者反应生成氯化钠和二氧化碳和水,二氧化碳溶解在水中形成饱和溶液,含有碳酸电离出的碳酸氢根离子,所以含量最多的三种离子的浓度关系为c(Na+)=c(Cl-)>c(HCO3-)。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】下列有关组成细胞化合物的说法,不正确的是
A. 蛋白质水解的终产物是氨基酸 B. 组成淀粉的基本单位是葡萄糖
C. RNA的单体是脱氧核糖核苷酸 D. 核酸是由许多核苷酸分子连接而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
A. 氧化性:Cr2O72->Fe3+>SO2
B. K2Cr2O7能将Na2SO3氧化成Na2SO4
C. 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D. 若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
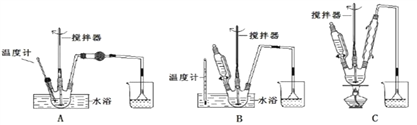
请回答下列问题:(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据不同的分类标准可将一种物质归属多个类别。现有下列物质:
①石墨和金刚石 ②1H、2H、3H ③O2和O3 ④正丁烷和异丁烷 ⑤H2C=CH2与CH3CH=CH2
⑥ 和
和 ⑦
⑦![]() 与
与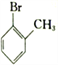 ⑧
⑧![]() 和
和![]()
回答下列问题:
(1)互为同位素的是____________________(填序号,下同)。
(2)互为同素异形体的是_____________________________。
(3)互为同系物的是__________________________。
(4)互为同分异构体的是__________________________。
(5)属于同一物质的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向蒸馏水中滴入少量盐酸后,下列说法中正确的是
A. c(H+)·c(OH-)不变
B. pH增大了
C. 水的电离程度增大了
D. 水电离出的c(H+)增加了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几种原子的基态电子排布,第一电离能最大的原子是( )
A. 1s22s22p6 B. 1s22s22p63s23p3
C. 1s22s22p63s23p2 D. 1s22s22p63s23p64s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com