
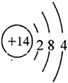
 ;
; ,
, ;
; ;
; ,
, ;
;

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、1molO2的质量是32g/mol |
| B、H2的摩尔质量是2g |
| C、1molH+的质量是1g |
| D、对原子而言,摩尔质量就是原子量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3粉尘 |
| B、FeO粉尘 |
| C、含溴粉尘 |
| D、含NO2粉尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水壶中水垢用食醋除去:2H++CaCO3=Ca2++CO2↑+H2O 2H++Mg(OH)2=Mg2++2H2O |
| B、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、向FeI2溶液中通入少量Cl2 2I-+Cl2=I2+2Cl- |
| D、等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(CO) |
| n(H2) |
| n(CO) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com