
| A. | ③④ | B. | ②③ | C. | ①④ | D. | ①② |
分析 ①酸式滴定管没有润洗,会导致标准液浓度被稀释,滴定时消耗的标准液体积偏大;
②俯视读数,导致量取的液体体积偏小;
③定容时仰视容量瓶刻度线,会导致加入的蒸馏水体积偏大;
④滴定前平视读数,滴定终点仰视读数,滴定时消耗的标准液体积偏大.
解答 解:①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗,导致标准液浓度减小,滴定过程中消耗的标准液体积偏大,测定结果偏高,故①错误;
②用量筒量取5.0mL溶液时,俯视读数,导致量取的液体体积偏小,故②正确;
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低,故③正确;
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数,滴定时消耗的标准液体积偏大,测定结果偏高,故④错误;
故选B.
点评 本题考查了实验操作中的误差分析,题目难度中等,涉及了配制一定物质的量浓度的溶液、中和滴定、计量仪器的使用等知识,注意明确分析实验误差的方法.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 | |
| B. | 图②表示向1 L l mol•L-1.FeBr2溶液中通入Cl2时Br-物质的量的变化 | |
| C. | 图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化 | |
| D. | 图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| C. | 铅蓄电池充电时的阴极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| D. | 以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2+Cl2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. ①、②、③3个-OH的酸性由强到弱的顺序是:
①、②、③3个-OH的酸性由强到弱的顺序是: .
.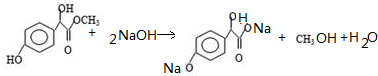 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 1.0L1.0mo1•L-1的KAlO2水溶液中含有的氧原子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物也不是同系物 )不是同系物,它们与氢气充分反应后的产物也不是同系物 | |
| C. | 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 | |
| D. | 四联苯( )的一氯代物有4种 )的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现象 | 无气体 | 产生气体 | 无气体 |
| A. | 1.00 mol•L-1 | B. | 0.50 mol•L-1 | C. | 1.50 mol•L-1 | D. | 2.00 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生欲通过实验方法验证 Fe2+的性质.
某学生欲通过实验方法验证 Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红综色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+═Fe3++NO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com