
 (g)+CO2(g)?
(g)+CO2(g)?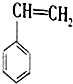 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
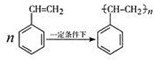 .
. 分析 (1)根据△H=反应物键能和-生成物键能和计算;
(2)①根据浓度熵规则计算Qc是否等于K来计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
③将反应改为恒压绝热条件下进行,根据压强和温度对化学平衡移动的影响来回答;
(3)根据化学反应前后,反应中气体的物质的量之比等于压强之比来回答;
(4)苯乙烯中的碳碳双键可以发生加聚反应得到聚苯乙烯.
解答 解:(1)据化学方程式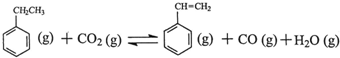 ,反应物和生成物中都有苯环,苯环的键能不必计算,有△H=反应物键能和-生成物键能和=2×348KJ/mol+5×413KJ/mol+2×745KJ/mol-348KL/mol-615KJ/mol-3×413KJ/mol-1076KJ/mol-2×463KJ/mol=+158.8KJ/mol,
,反应物和生成物中都有苯环,苯环的键能不必计算,有△H=反应物键能和-生成物键能和=2×348KJ/mol+5×413KJ/mol+2×745KJ/mol-348KL/mol-615KJ/mol-3×413KJ/mol-1076KJ/mol-2×463KJ/mol=+158.8KJ/mol,
故答案为:+158.8KJ/mol;
(2)①反应 进行到某时刻测得混合物中各组分的物质的量均为1.0mol,即浓度都是0.5mol/L,此时Qc=$\frac{0.{5}^{3}}{0.{5}^{2}}$=0.5=K,所以达到化学平衡状态,
进行到某时刻测得混合物中各组分的物质的量均为1.0mol,即浓度都是0.5mol/L,此时Qc=$\frac{0.{5}^{3}}{0.{5}^{2}}$=0.5=K,所以达到化学平衡状态,
故答案为:是;
②A、正、逆反应速率的比值恒定,说明正逆反应速率是相等的,所以达到了化学平衡状态,故A正确;
B、c(CO2)与c(CO)的浓度是否相等,与反应的起始量和转化率有关,所以当c(CO2)=c(CO)时,不能说明已经达到平衡状态,故B错误;
C、反应前后体积不变,质量守恒,所以体系的密度始终不变,故不能用密度判断平衡,故C错误;
D、随着反应的进行CO2的体积分数逐渐减小,当CO2的体积分数保持不变,即是平衡状态,故D正确.
故答案为:AD;
③该反应为正向吸热、气体体积增大的反应,若维持恒压绝热,则相当于在原平衡基础降温同时增加容器容积,二者对乙苯的浓度影响不能判定,故答案为:d;
(3)已知信息,设乙苯的变化浓度是x,则

初始浓度:2.0 3.0 0 0 0
变化浓度:x x x x x
平衡浓度:2.0-x 3.0-x x x x
则$\frac{2.0-x+3.0-x+3x}{5.0}$=$\frac{P}{{P}_{0}}$,解得x=$\frac{5(P-{P}_{0})}{{P}_{0}}$,则反应达到平衡时苯乙烯的浓度为$\frac{5(P-{P}_{0})}{{P}_{0}}$,乙苯的转化率为$\frac{5(P-{P}_{0})}{2{P}_{0}}$×100%=$\frac{2.5(P-{P}_{0})}{{P}_{0}}$×100%,
故答案为:$\frac{5(P-{P}_{0})}{{P}_{0}}$;$\frac{2.5(P-{P}_{0})}{{P}_{0}}$×100%;
(4)苯乙烯在一定条件下合成聚苯乙烯的化学方程式为: ,故答案为:
,故答案为: .
.
点评 本题综合性较大,涉及化学平衡状态的判断、浓度熵规则、化学平衡的计算等知识,注意知识的归纳和整理是关键,难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | “O”既可以表示宏观上的氧元素,也可以表示微观的一个氧原子 | |
| B. | 烧碱、纯碱按物质分类都属于碱 | |
| C. | 氧气、臭氧均为氧单质,所以物理性质、化学性质完全相同 | |
| D. | 泡沫灭火器的灭火原理是降低了可燃物的着火点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式分别为C2H6O、C3H8O的有机物一定互为同系物 | |
| B. | 若有机物甲和乙为同分异构体,则甲和乙的化学性质相似 | |
| C. | 某有机物燃烧只生成物质的量之比为1:2的CO2和H2O,说明其最简式为CH4 | |
| D. | 丙烯(CH2=CHCH3)易发生加成反应,一定条件下也可能取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2,2,3,3-四甲基戊烷由烯烃加成而来,则该烯烃的名称是2,2,3,3-四甲基-1--戊烯 | |
| B. | 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大 | |
| C. | 在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 容器体 积/L | 平衡时O2转化率 | 平衡时 压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1>p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
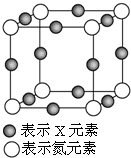 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )| A. | X元素的原子序数为28 | |
| B. | 晶体中与一个N3-距离最近的Xn+为8个 | |
| C. | Xn+中n的值为1 | |
| D. | 该晶体中N3-与Xn+的个数比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
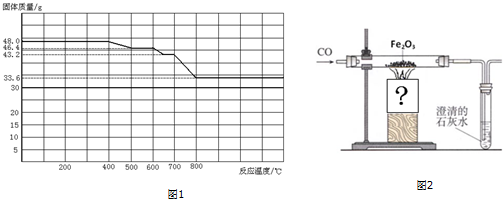
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com