
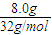 =0.25mol,根据反应的化学方程式2Na2O2+2CO2=Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑计算,
=0.25mol,根据反应的化学方程式2Na2O2+2CO2=Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑计算,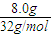 =0.25mol,n(CO2和H2O)=0.5mol,
=0.25mol,n(CO2和H2O)=0.5mol,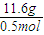 =23.2g/mol,
=23.2g/mol,

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
200 ℃?时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应,反应后固体的质量增加了3.6 g。则原混合气体的平均相对分子质量为( )
A.5.8 B.11.6?
C.23.2 D.46.4
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省丹东市高三上学期期末考试化学试卷(解析版) 题型:选择题
200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体冷却后加入含有 、
、 、
、 、
、 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是
( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是
( )
A.原混合气体的平均摩尔质量为23.2 g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25 mol
C.溶液中 的物质的量浓度基本保持不变
的物质的量浓度基本保持不变
D.溶液中 的物质的量浓度减小,
的物质的量浓度减小, 的物质的量浓度增大,但是
的物质的量浓度增大,但是 和
和 的物质的量浓度之和基本保持不变
的物质的量浓度之和基本保持不变
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为
A.5.8 B.11.6 C.23.2 D.46.4
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江金华一中高三上学期期中考试化学试卷 题型:选择题
200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体密封冷却后加入含有Na+、HCO、SO、CO等离子的水溶液中,假设加入后溶液体积保持不变,则下列说法中正确的是
A.原混合气体中CO2和水蒸气各0.25mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.50 mol
C.溶液中SO的物质的量浓度基本保持不变
D.溶液中HCO的物质的量浓度减小,CO的物质的量浓度增大,但是HCO和CO的物质的量浓度之和基本保持不变
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三上学期期中考试化学试卷 题型:选择题
200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为 ( )
A.5.8 B.11.6 C.23.2 D.46.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com