
| A. | NaCl | B. | BaCl2 | C. | MgCl2 | D. | AlCl3 |
分析 假设100g全部为CaCl2,则生成AgCl为$\frac{100g}{111g/mol}$×2×143.5g/mol=258.6g>200g,故除杂中氯离子含量应小于CaCl2中氯离子含量,若全部为杂质,生成AgCl的质量应小于200g.
解答 解:假设100g全部为CaCl2,则生成AgCl为$\frac{100g}{111g/mol}$×2×143.5g/mol=258.6g>200g,故除杂中氯离子含量应小于CaCl2中氯离子含量,
CaCl2中Ca、Cl质量之比为40:71,而NaCl中Na、Cl质量之比为46:71,BaCl2中Ba、Cl质量之比为137:71,MgCl2中Mg、Cl质量之比为24:71,AlCl3中Al、Cl质量之比为27:35.5×3=18:71,故NaCl、BaCl2中氯离子含量小于CaCl2中氯离子含量,
假设100g全部为NaCl,生成AgCl沉淀为$\frac{100g}{58.5g}$×143.5g/mol=245.3g>200g,不符合题意;
假设100g全部为BaCl2,生成AgCl为$\frac{100g}{208g/mol}$×2×143.5g/mol=138g<200g,符合题意,
故选:B.
点评 本题考查混合物的计算,题目难度中等,注意用端值法解答,属于易错题目,学生容易考虑氯离子含量小于氯化钙中氯离子含量,忽略若全部为杂质时生成AgCl的质量应小于200g.


科目:高中化学 来源: 题型:多选题
| A. | 品红溶液通入SO2气体后红色消失 | |
| B. | 显红色的酚酞溶液通入SO2后红色消失 | |
| C. | 酸性KMnO4溶液通入SO2后紫色消失 | |
| D. | 溴水通入SO2气体后橙色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| B. | 石英容器可盛放任何酸 | |
| C. | 生活中使用明矾净水,除去水中的悬浮的微小颗粒 | |
| D. | 向NaOH溶液中滴加FeCl3溶液制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g/mol | B. | 60 g/mol | C. | 90g/mol | D. | 120 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2=Ca2++Cl2? | B. | Na2SO4=Na++SO42- | ||
| C. | HNO3=H++NO3- | D. | NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在空气中燃烧发白光、放热 | |
| B. | 氧化反应是指物质与氧气发生的化合反应 | |
| C. | 凡是在空气中不能燃烧的物质,在纯氧中也不能燃烧 | |
| D. | 蜡烛燃烧、食物腐败都是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
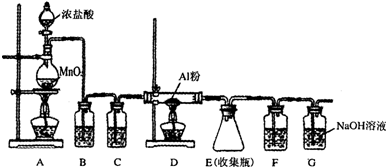
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锌铁皮镀层受损后,铁比受损前更容易生锈 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)增大 | |
| D. | 一定条件下水由气态变为液态是熵增加的过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com