
| A. | H2CO3?H2O+CO2↑ | B. | KOH═K++O2-+H+ | ||
| C. | HClO═H++ClO- | D. | Na2CO3═2Na++CO32- |
科目:高中化学 来源: 题型:选择题
| A. | Y单质能溶于X元素的最高价氧化物的水化物 | |
| B. | W2能与H2Z发生置换反应 | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X形成两种离子化合物,阴、阳离子个数比一定是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 单质钠具有很强的还原性,钠离子具有很弱的氧化性 | |
| C. | Na着火时不能用水灭火,可用细沙覆盖灭火 | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
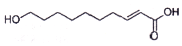 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )| A. | 含有两种官能团 | |
| B. | 与足里NaOH反应生成Cl0H18O3Na2 | |
| C. | 能发生加成反应,氧化反应、取代反应、加聚反应 | |
| D. | 能使Br/CCl4溶液、酸性KMnO4溶液褪色,褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
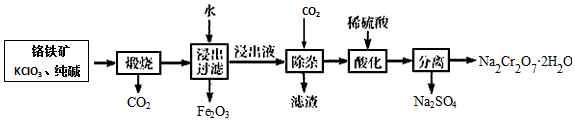
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com