
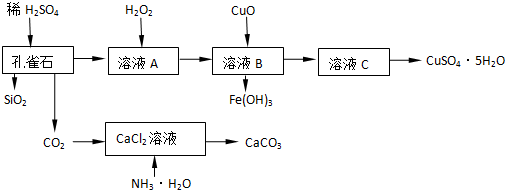

分析 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀硫酸溶解反应生成二氧化碳,硫酸亚铁、硫酸铜的混合溶液A,过滤得到二氧化硅,在溶液A中加入过氧化氢氧化亚铁离子为铁离子,加入氧化铜调节溶液的PH生成氢氧化铁沉淀,过滤得到溶液C为硫酸铜溶液,通过加热浓缩、冷却结晶、过滤洗涤,干燥得到硫酸铜晶体,二氧化碳通入加入氨水的氯化钙溶液生成碳酸钙沉淀,
(1)向溶液A中加入H2O2,过氧化氢氧化亚铁离子为铁离子,过氧化氢被还原产物为水无污染,氯气做氧化剂会引入杂质离子氯离子;
(2)硫酸铜溶液通过加热浓缩、冷却结晶、过滤洗涤,干燥得到硫酸铜晶体,过滤装置中用到的玻璃仪器为烧杯、玻璃棒、漏斗;
(3)氯化钙溶液中加入氨水后再通入二氧化碳会生成碳酸钙沉淀和氯化铵,氨气是极易溶于水的气体吸收需要放置倒吸.
解答 解:孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀硫酸溶解反应生成二氧化碳,硫酸亚铁、硫酸铜的混合溶液A,过滤得到二氧化硅,在溶液A中加入过氧化氢氧化亚铁离子为铁离子,加入氧化铜调节溶液的PH生成氢氧化铁沉淀,过滤得到溶液C为硫酸铜溶液,通过加热浓缩、冷却结晶、过滤洗涤,干燥得到硫酸铜晶体,二氧化碳通入加入氨水的氯化钙溶液生成碳酸钙沉淀,
(1)在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+.向溶液A中加入H2O2,过氧化氢氧化亚铁离子为铁离子,H2O2在该反应中氧化Fe2+的离子反应方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,过氧化氢被还原产物为水无污染,氯气做氧化剂会引入杂质离子氯离子,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;Cl-;
(2)硫酸铜溶液通过加热浓缩、冷却结晶、过滤洗涤,干燥得到硫酸铜晶体,过滤装置中用到的玻璃仪器为烧杯、玻璃棒、漏斗,该仪器在此操作中的主要作用是引流作用,
故答案为:冷却结晶; 引流;
(3)氯化钙溶液中加入氨水后再通入二氧化碳会生成碳酸钙沉淀和氯化铵,反应的化学方程式为:CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O,氨气是极易溶于水的气体吸收需要放置倒吸,装置图中只有B能充分吸收氨气且不发生倒吸,A倒吸后会到西道发生装置中,CD和导气管直接插入溶液一样不能防止倒吸,故选B,
故答案为:B.
点评 本题考查了物质的分离提纯过程分析判断,主要是杂质除去的试剂选择和物质性质的理解应用,掌握基础是解题关键,题目难度中等.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成由易到难:HF>HCl>HBr>HI | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 酸性:HF>HCl>HBr>HI | D. | 酸性:HClO4<HBrO4<HIO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①和②是可逆反应 | B. | 反应①和②一定为氧化还原反应 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | X元素为铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A+3B?2C | B. | 2A+2B?3C | C. | 3A+B?C | D. | A+B?C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的质软金属,密度都很小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 碱金属单质与水剧烈反应生成碱和H2 | |
| D. | 单质熔沸点随着原子序数的增加而升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com