
 .
.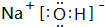 ,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,并用电子式表示其形成过程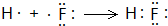 .
.分析 ①A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、B为Mg、C为Al;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,二者元素最低负化合价为-1,二者都处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;
③F在常温下是气体,是制作漂白液的主要原料之一,则F为Cl;
④G是除氢外原子半径最小的元素(不考虑稀有气体),则G为F元素.
解答 解:①A、B、C是同一周期的金属元素,原子核外有3个电子层,处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,则A为Na、B为Mg、C为Al;
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,二者元素最低负化合价为-1,二者都处于ⅦA族,在室温时,D的单质是液体,E的单质是固体,则D为Br、E为I;
③F在常温下是气体,是制作漂白液的主要原料之一,则F为Cl;
④G是除氢外原子半径最小的元素(不考虑稀有气体),则G为F元素.
(1)由上述分析可知,E为碘,碘单质元素为紫黑色,
故答案为:紫黑色;
(2)F为Cl元素,原子结构示意图是为 ,
,
故答案为: ;
;
(3)在上述七种元素中,最高价氧化物对应的水化物酸性最强的物质的是HClO4,最高价氧化物对应的水化物碱性最强的是NaOH,电子式是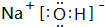 ,气态氢化物最稳定的物质是HF,用电子式表示其形成过程
,气态氢化物最稳定的物质是HF,用电子式表示其形成过程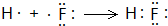 ,
,
故答案为:HClO4;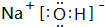 ;HF;
;HF;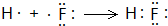 ;
;
(4)A、C的氧化物对应的水化物分别为NaOH、Al(OH)3,反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)B为Mg元素,在周期表中位置是:第三周期第ⅡA族,
故答案为:第三周期第ⅡA族.
的名称是钠,B为Mg,位于周期表中第三周期ⅡA族,C为Al,原子结构示意图是 ,故答案为:钠;三;ⅡA;
,故答案为:钠;三;ⅡA; ;
;
(2)E为I,其单质颜色是紫黑色,故答案为:紫黑色;
(3)A元素与D元素形成化合物为NaBr,电子式是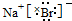 ,故答案为:
,故答案为: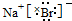 ;
;
(4)G的单质为氟气,与水反应的化学方程式是:2F2+2H2O═4HF+O2,故答案为:2F2+2H2O═4HF+O2;
(5)F的元素符号是He,故答案为:He;
(6)在上述七种元素中,Na的金属性最强,最高价氧化物对应的水化物碱性最强的化学式是NaOH,F的非金属性最强,气态氢化物最稳定的化学式是HF,故答案为:NaOH;HF.
点评 本题综合性较强,考查的知识面较广,但比较基础,熟练掌握元素化合物性质与元素周期律,注意对基础知识的全面掌握,掌握用电子式表示化学键或物质的形成.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH | B. | (CH3)3CCH2OH | C. | HOCH2CHBrCH3 | D. | CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
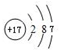
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“.”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“.”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径不一定越大 | |
| B. | 图中直线相连的元素处于不是同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B两种元素组成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬(Cr)有许多种化合物,在工业生产中有广泛的用途.
铬(Cr)有许多种化合物,在工业生产中有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+ | B. | 热稳定性:HCl>HF | ||
| C. | 酸性:H3BO3>H2CO3 | D. | 碱性:Al(OH)3>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | 催化剂 | 温度 | |
| A | 10mL20% H2O2溶液 | 无 | 40℃ |
| B | 10mL20% H2O2溶液 | 无 | 25℃ |
| C | 10mL20% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 | 40℃ |
| D | 10mL10% H2O2溶液 | 无 | 25℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com