
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
【答案】:![]() 否 0.0015mol/(L·min)。 正反应是体积减小的可逆反应,增大压强,平衡向正反应方向移动,有利于金刚石的制备。 3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol
否 0.0015mol/(L·min)。 正反应是体积减小的可逆反应,增大压强,平衡向正反应方向移动,有利于金刚石的制备。 3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol
【解析】
根据方程式书写平衡常数表达式;根据化学反应化学反应速率计算公式求CO2的平均反应速率;根据影响化学平衡移动影响因素判断;根据盖斯定律书写热化学反应方程式。
(1)金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石),该反应的平衡常数表达式为K=
2Na2CO3(1)+C(s,金刚石),该反应的平衡常数表达式为K=![]() 。若3v正(Na)=4v逆(CO2),该反应达到平衡状态,若4v正(Na)=3v逆(CO2),则该反应不能达到平衡状态;
。若3v正(Na)=4v逆(CO2),该反应达到平衡状态,若4v正(Na)=3v逆(CO2),则该反应不能达到平衡状态;
答案:![]() ;否;
;否;
(2)反应时间为10min,金属钠的物质的量减少了0.2mol,则根据方程式可知消耗CO2的物质的量是0.15mol,浓度是0.015mol/L,因此10min里CO2的平均反应速率为0.015mol/L÷10min=0.0015mol/(L·min);答案:0.0015mol/(L·min)。
(3)根据方程式4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
可知,正反应是体积减小的可逆反应,因此增大压强,平衡向正反应方向移动,有利于金刚石的制备。答案:正反应是体积减小的可逆反应,增大压强,平衡向正反应方向移动,有利于金刚石的制备。
(4)根据反应①4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石)△H=-357.5kJ/mol,则根据盖斯定律可知①-②![]() 3即得到6Na 2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(1) △H =-8.4 kJ/mol,所以热化学方程式为:3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol。
3即得到6Na 2O(s)+2C(s,金刚石)=8Na(g)+2Na2CO3(1) △H =-8.4 kJ/mol,所以热化学方程式为:3Na 2O(s)+C(s,金刚石)=4Na(g)+Na2CO3(1) △H =-4.2 kJ/mol。


科目:高中化学 来源: 题型:
【题目】下列物质为常见有机物:①甲苯;②1,3-丁二烯;③直馏汽油;④植物油。
(1)既能使溴水因发生化学变化褪色,也能使酸性高锰酸钾褪色的烃是____(填编号);
(2)能和氢氧化钠溶液反应的是__________(填编号),写出该反应产物之一与硝酸酯化的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种镁铝合金样品(组分比例不一定相同)①、②、③。小奉、小贤、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究:
(1)小奉取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为___________。(保留小数点后面2位)
(2)小贤取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m2的取值范围是_________。(结果转化为最简分数)
(3)小红取不同质量的样品③分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下所示:
实验序号 | a | b | c |
合金质量(g) | 0.51 | 0.765 | 0.918 |
气体体积(mL) | 560 | 672 | 672 |
求:I.盐酸的物质的量浓度_______
II.合金中镁的质量分数_______
III.要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少mL_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铝是一种常用皮革鞣剂.工业上用铝灰(主要含Al、A12O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3﹒nH2O]的流程如下:
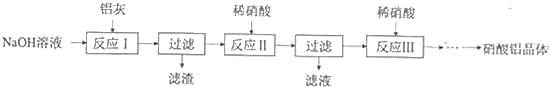
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有______。
a.容量瓶 b.量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是______。
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、______、过滤、______、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因______。
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
氢氧化物 | Fe(OH)3 | Al(OH)3 |
开始沉淀pH | 1.9 | 4.2 |
沉淀完全pH | 3.2 | 5.4 |
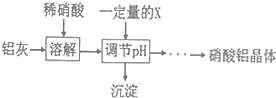
调节pH的目的是______,为使得到的硝酸铝晶体较纯净,所用的X物质可以是______(填编号)。
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是______。
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
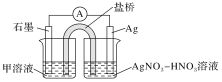
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO![]() )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
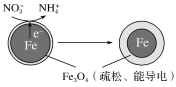
上图中作负极的物质是___________。正极的电极反应式是______________。
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。 电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
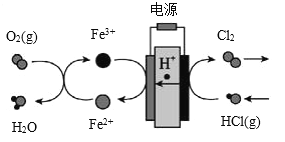
(4)KClO3也可采用“电解法”制备,装置如图所示。
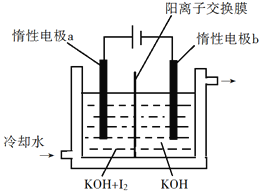
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
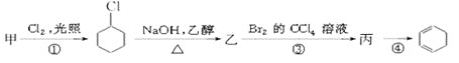
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知葡萄糖(C6H12O6)的燃烧热是2804kJ·mol-1,当它在人体内氧化生成1g水时放出的热量约为( )
A.26.0kJB.51.9kJC.155.8kJD.467.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com