
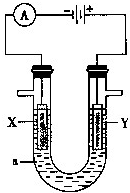
 ���ԭ���ڻ�ѧ��ҵ���й㷺��Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ������
���ԭ���ڻ�ѧ��ҵ���й㷺��Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ������


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ĵ缫��ӦʽΪLi-e-=Li+ |
| B���õ�صĵ������Һ������ϡ���� |
| C������ڲ�Li+���ƶ� |
| D�����ʱ�����������ĵ缫��ӦʽΪ��Li2S+Fe-2e-�T2Li++FeS |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ͼΪ��ⱥ��ʳ��ˮʾ��ͼ������˵����ȷ���ǣ�������
ͼΪ��ⱥ��ʳ��ˮʾ��ͼ������˵����ȷ���ǣ�������| A�������������� |
| B�������Ϸ���������Ӧ |
| C�����ʱ����Һ��pH���� |
| D�����Դ�����������ǵ��ص����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� | �����Լ� | ʵ������ |
| �� | 4mL 2mol?L-1 HCl��Һ | �����ܽ� |
| �� | 4mL 2mol?L-1 NH4Cl��Һ | �����ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | ���ձ��м�����Լ�����������mL�� | ���� | ��Һ��ʼ����ʱ�䣨min�� | ||||
| 0.1 mol?L-1 KI��Һ |
H2O | 0.01 mol?L-1 X ��Һ |
0.1 mol?L-1 ˫��ˮ |
1 mol?L-1 ϡ���� | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | �� | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | �� | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | �� | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | �� | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5��Fe2��SO4��3 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| HNO3 |
| O2 |
| HNO3 |
| O2 |
| H2O |
| HNO3 |
| H2SO4 |
| Ba(NO3)2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.006 | 0.004 | 0.004 | 0.004 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ �� �� �� | ʵ �� Ŀ �� | |
| A | ��SO2ͨ������KMnO4��Һ�� | ֤��SO2��ˮ��Һ���������� |
| B | �����͵�FeCl3��Һ�ε���ˮ�� | �ٽ�Fe3+ˮ�⣬�Ƶ�Fe��OH��3���� |
| C | �ڵ���KI��Һ�еμ���������ʳ�����Ƶ���Һ | ��ٵ��εļ��� |
| D | ������Fe��NO3��2������ˮ�ܽ����Һ�У��μ�ϡH2SO4�ữ���ٵμ�KSCN��Һ | ����Fe��NO3��2�����Ƿ���� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com