
| A�� | 1 mol Na2O2�����к���������Ϊ3NA | |
| B�� | 0.10 mol Fe��������ˮ������Ӧ���ɵ�H2������Ϊ0.10NA | |
| C�� | 40g NaOH����1Lˮ�У�����NaOH ��Һ�����ʵ���Ũ��Ϊ1mol/L | |
| D�� | ��״���£�11.2L���к��з��ӵ���ĿΪ0.5NA |
���� A��Na2O2�к�2�������Ӻ�1����������
B������ˮ������Ӧ������������������������������Ԫ�ص�ƽ�����ϼ�Ϊ$\frac{8}{3}$�ۣ����ݵ����غ������������������ʵ�����
C����Һ�������1L��
D������£���ΪҺ̬��
��� �⣺A��Na2O2�к�2�������Ӻ�1������������1molNa2O2�к�2mol�����Ӻ�1mol������������3mol���ӣ���A��ȷ��
B������ˮ�����ķ�Ӧ����Ϊ��������������������������Ԫ�ص�ƽ�����ϼ�Ϊ$\frac{8}{3}$�ۣ�0.10mol������ȫ��Ӧʧȥ���ӵ����ʵ���Ϊ��0.10mol��$\frac{8}{3}$=$\frac{4}{15}$mol���������������ʵ���Ϊ��$\frac{2}{15}$mol�����������ķ�����Ϊ$\frac{2}{15}$NA����B����
C����Һ�������1L����40g NaOH���ʵ���Ϊ1mol������1Lˮ�У���Һ�������1L��������Һ�����ʵ���Ũ��С��1mol/L����C����
D������£���ΪҺ̬���ʲ��ܸ�������Ħ����������㣬��D����
��ѡA��
���� ���⿼���˰���٤���������йؼ��㣬�������չ�ʽ��ʹ�ú����ʵĽṹ�ǽ���ؼ����ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A�� | ����0.1 mol��L-l NaC1O��Һ����pH��pHС��9.7 | |
| B�� | 0��lmo1��L-1Na2CO3��Һ�У��������¹�ϵ��c��OH-��-c��H+��=c��HCO3��+2c��H2CO3�� | |
| C�� | �����ϱ����ݵó����������ƽ�ⳣ����С��ϵΪ��HF��HC1O��H2CO3��һ������ƽ�ⳣ���� | |
| D�� | pH=2��HF��Һ��pH=12��NaOH��Һ�����1��1��ϣ�����c��Na+��=c��F-����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڶ���ӵ�ԭ��������ߵĵ���ͨ������˽��������ڻ | |
| B�� | ����������������������͵ĵ��Ӳ��ϣ�����ֻ��������M������N�� | |
| C�� | ����������������������͵ĵ��Ӳ��� | |
| D�� | ���������ֻ����8�����Ӳ��ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Fe��NO3��2��KI�����Һ�м�������ϡ���3Fe2++4H++NO3-=3Fe3++2H2O+NO�� | |
| B�� | ��ĭ����������ԭ����2Al3++3CO32-+3H2O=2Al��OH��3��+3CO2�� | |
| C�� | ����������Һ�м��������İ�ˮ��Ag++2NH3•H2O=Ag��NH3��2++2H2O | |
| D�� | �������İ�ˮ�������Ṥҵ��β����SO2+NH3•H2O=NH4++HSO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�Ӱ뾶��A��D��C��B | |
| B�� | ����⻯����ȶ��ԣ�D��C | |
| C�� | A��C�γɵĻ���������ˮ������Һ�Լ��� | |
| D�� | B��D�γɵĻ���������ˮ������Һ�Լ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 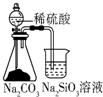 ����ͼ�ɱȽ���̼��������Ԫ�صķǽ�����ǿ�� | |
| B�� | 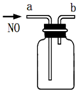 ����ͼװ���ռ�һƿ������NO | |
| C�� |  ����ͼװ����U��������Һ����ұ��ֲ���ʱ֤��װ�ò�©�� | |
| D�� | 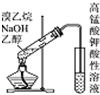 ����ͼ������������NaOH�Ĵ���Һ���Ȳ�������ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
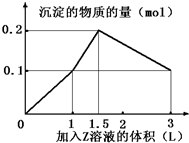 ij�����Һ�У�������X��Y��0.1mol�������еμ�0.1mol/L��Z��Һ�����ó��������ʵ�����ͼ�������������X��Y��Z�ֱ��ǣ�������
ij�����Һ�У�������X��Y��0.1mol�������еμ�0.1mol/L��Z��Һ�����ó��������ʵ�����ͼ�������������X��Y��Z�ֱ��ǣ�������| A�� | �Ȼ������Ȼ������������� | B�� | �Ȼ������Ȼ�þ���������� | ||
| C�� | ƫ�����ơ��Ȼ��������� | D�� | ƫ�����ơ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��V��22.4Lʱ������CO2�����ͨ�룬��Һ����ˮ������c��H+�������� | |
| B�� | ��V=22.4Lʱ��������Һ�д��ڣ�c��Na+����c��CO32-����c��OH-����c��HCO3-����c��H+�� | |
| C�� | ��22.4L��V��44.8Lʱ��������Һ��һ�����ڣ�c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| D�� | ��V=44.8Lʱ��������Һ�д��ڣ�c��OH-��+c��CO32-��=c��H+��+C��H2CO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com