
【题目】在恒温(500K)、体积为2.0L 的密闭容器中通入1.0 mol N2和1 mol H2发生合成氨反应,20 min 后达到平衡,测得反应放出的热量为 18.4 kJ,混合气体的总物质的量为 1.6 mol。
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率V(NH3)=__________。
(2)该反应的热化学方程式为_____________________________________________。
(3)若拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)判断该反应达到平衡状态的依据是____________(填序号)。
①单位时间内消耗1mol N2 的同时消耗了3mol H2 ;
②单位时间内断裂1mol N≡N 的同时断裂了6mol N–H;
③V正(N2)=V逆(NH3);
④NH3的物质的量分数不再随时间而变化
⑤容器内气体的压强不再随时间而变化的状态 ;
⑥容器内气体的密度不再随时间而变化的状态;
⑦c(N2):c(H2):c(NH3)=1:3:2 ;
【答案】0.01 molL1min1 N2(g)+3H2(g)![]() 2NH3(g) △H=92.4 kJ/mol 391 ②④⑤
2NH3(g) △H=92.4 kJ/mol 391 ②④⑤
【解析】
在恒温,体积为2L的密闭容器中通入1molN2和1molH2,20min后达到平衡,测得反应放出的热量为 18.4 kJ,混合气体的物质的量为1.6mol;
设消耗的氮气为n mol,则:
N2(g)+3H2(g)2NH3(g)
起始量(mol):1 1 0
变化量(mol):n 3n 2n
平衡量(mol):1-n 1-3n 2n
所以:1-n+1-3n+2n=1.6,解得n=0.2,1mol氮气反应放出的热量为18.4kJ×![]() =92kJ,
=92kJ,
(1)V(NH3)=![]() ;
;
(2)计算1mol氮气反应放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(3)反应热△H=反应物的键能和-生成物的键能和;
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡。
在恒温,体积为2L的密闭容器中通入1molN2和1molH2,20min后达到平衡,,测得反应放出的热量为 18.4 kJ,混合气体的物质的量为1.6mol;
设消耗的氮气为n mol,则:
N2(g)+3H2(g)2NH3(g)
起始量(mol):1 1 0
变化量(mol):n 3n 2n
平衡量(mol):1-n 1-3n 2n
所以:1-n+1-3n+2n=1.6,解得n=0.2,1mol氮气反应放出的热量为18.4kJ×![]() =92kJ,
=92kJ,
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率V(NH3)=![]() =
=![]() = 0.01 molL1min1;
= 0.01 molL1min1;
(2)1mol氮气反应放出的热量为18.4kJ×![]() =92kJ,则发生反应的热化学方程式为热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92kJ/mol;
=92kJ,则发生反应的热化学方程式为热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92kJ/mol;
(3)设拆开1 mol N—H键需要的能量是QkJ,则反应热△H=反应物的键能和-生成物的键能和=(946kJ/mol)+(436 kJ/mol)×3-(Q kJ/mol)×6=-92kJ/mol,解得:Q=391;
(4)①单位时间内消耗1molN2 的同时消耗了3molH2,均表示正反应,无法判断反应是平衡状态,故①错误;
②单位时间内断裂1molN≡N的同时断裂了6molN–H,说明正逆反应速率相等,此时反应达到平衡状态,故②正确;
③当2V正(N2)=V逆(NH3)时反应才达到平衡状态,则V正(N2)=V逆(NH3)时反应不是平衡状态,故③错误;
④NH3的物质的量分数不再随时间而变化,说明反应达到平衡状态,故④正确;
⑤在恒温恒容条件下,容器内气体的压强不再随时间而变化的状态,说明混合气体的总物质的量不再改变,此时是平衡状态,故⑤正确;
⑥容器内气体的总质量不变,气体体积也不变,则密度一直不变,无法确定是平衡状态,故⑥错误;
⑦c(N2):c(H2):c(NH3)=1:3:2无法说明各组分的浓度保持不变,不能确定反应达到平衡状态,故⑦错误;
故答案为②④⑤。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50 mL去离子水搅拌溶解。
②另取4.0 g硫粉于200mL烧杯中,加6 mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2 g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中, ______________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。
(4)滤液中除Na2S2O3和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00 g产品(硫代硫酸钠晶体的摩尔质量为248 g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol/L碘标准溶液滴定至终点,消耗21.00 mL。反应的离子方程式为:2S2O32-+I2=S4O62-+2I-。
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3常用于脱氯剂,在溶液中易被Cl2氧化为SO42-,该反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
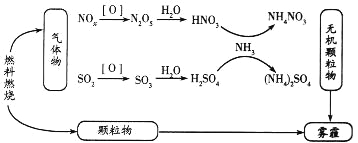
回答下列问题:
(1)NH3的电子式为____________,NH4NO3中含有的化学键是________________:
(2)下列关于雾霾的叙述错误的是________(填序号)
A.雾霾中含有硝酸铵和硫酸铵 B.NH3是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关 D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入O2充分反应生成一种正盐,该反应的化学方程式为________________________。预防含氮化合物雾霾生成的方法之一是用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸,电解后该溶液的pH_______(填“变大”“变小”或“不变”)。
(4)在有氧条件下,催化剂能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,NOx的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是__________________________。在无氧条件下,反应器中NH3能将NO2还原为N2,当生成1mol N2时转移电子________mol(可用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件已略去)。下列推断错误的是
![]()
A. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
B. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
C. 若D是一种强碱,则A.B.C均可与X反应生成D
D. 若D是一种强酸,则A 既可是单质也可是化合物,且D 可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子核磁共振谱(NMR)是研究有机化合物结构的有力手段之一。在所研究化合物的分子中,每一结构中的等性氢原子,在NMR谱中都给出相应的峰(信号)。谱中峰的强度与结构中的H原子数成正比。例如,乙醛的结构式为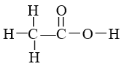 ,其NMR谱中有两个信号,其强度之比为3∶1。
,其NMR谱中有两个信号,其强度之比为3∶1。
(1)分子式为C3H6O2的二元混合物,如果在NMR谱中观察氢原子给出的峰有两种情况:第一种情况峰的强度比为3∶3;第二种情况峰的强度比为3∶2∶1。由此可推断该混合物的组成可能是(写结构简式)_____________________。
(2)在测得的CH3CH2CH2CI化合物的.NMR谱上可观察到三种峰,而测定化合物CH3CH=CHCl时,却得到氢原子给出的6个信号峰。根据原子空间排列方式不同,试写出CH3CH=CHCl分子的空间异构____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们对苯的认识有一个不断深化的过程。已知分子式为 C6H6的结构有多种,其中的两种为:
Ⅰ.![]() Ⅱ.
Ⅱ.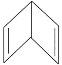
(1)这两种结构的化学性质区别表现在:Ⅰ能________(填字母,下同),而Ⅱ能________。
A.被酸性KMnO4溶液氧化
B.与溴水发生加成反应
C.与氢气发生加成反应
(2)1 mol C6H6与H2发生完全加成反应,Ⅰ需________molH2,而Ⅱ需________mol H2。
(3)今发现C6H6还可能有另一种如下图所示的立体结构,该结构的二氯代物有_________种。
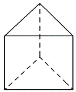
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为2K2S2+KI3![]() K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
K2S4 +3KI。装置(Ⅱ)为电解池的示意图,当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法不正确的是( )
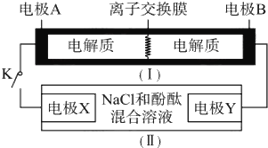
A. K+从左到右通过离子交换膜 B. 电极A上发生的反应为I3-+2e-=3I-
C. 电极Y上发生的反应为2Cl--2e-=Cl2↑ D. 当有0.1 molK+通过离子交换膜,X电极上产生1.12L气体(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com