
 ;
;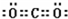 ;
;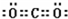 ;共价键;
;共价键;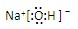 ,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键;
,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键;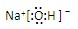 ,离子键,共价键;
,离子键,共价键;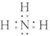 ;
;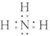 ,共价键;
,共价键; ;
; ,共价键;
,共价键; ,
, .
.


科目:高中化学 来源: 题型:

| A、甲池中通甲烷的极是负极,溶液中Na+向Pt电极移动 | ||||
| B、C电极的电极反应为:O2+4e-+4H+═2H2O | ||||
C、乙池中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中,甲、乙装置中溶液的pH都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚是一种弱酸,滴加指示剂变色 |
B、苯酚在水溶液中能按下式电离: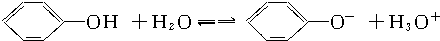 |
| C、苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性 |
| D、苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).| n(CO2) |
| n(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com