
分析 ①铝热反应本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁;
②CaO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水;
③放出4.48L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化钙、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
④用KSCN溶液检验时,溶液D不变色,说明不含铁离子;
(1)依据铝热反应写出化学方程式;
(2)③中所发生的各反应Fe与盐酸反应生成氯化亚铁与氢气,铁与氯化铁反应生成氯化亚铁;
(3)令CaO和Fe2O3的物质的量分别为xmol,根据二者质量计算x的值,溶液D为氯化镁、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Ca2+)=n(CaO),再根据c=nV计算镁离子浓度,根据电荷守恒溶液中2c(Ca2+)+2c(Fe2+)=c(Cl-),据此计算亚铁离子浓度.
解答 解:(1)CaO和Fe2O3组成的混合物行铝热反应,发生Al与Fe2O3反应,置换出铁,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
故答案为:Fe;
(2)放出4.48L(标准状况)气体,说明生成氢气,溶液C为氯化铁、氯化钙、盐酸的混合溶液,Fe和溶液C反应为:Fe与盐酸反应生成氯化亚铁与氢气,反应离子方程式为 Fe+2H+=Fe2++H2↑;铁与氯化铁反应生成氯化亚铁,反应离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+;
(3)令CaO和Fe2O3的物质的量分别为xmol,则56x+160x=21.6,解得x=0.1,溶液D为氯化钙、氯化亚铁的混合溶液,根据镁元素守恒可知,n(Ca2+)=n(CaO)=0.1mol,所以c(Ca2+)=$\frac{0.1mol}{0.2L}$=0.5mol/L;根据电荷守恒溶液中2c(Ca2+)+2c(Fe2+)=c(Cl-),所以2×0.5mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.5mol/L,
故答案为:0.5mol/L;2.5mol/L.
点评 本题考查常用化学用语、物质的量浓度计算等,难度中等,理解反应过程是解题的关键,注意(3)利用电荷守恒计算比过程计算法要简单.


科目:高中化学 来源: 题型:选择题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH值 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| A. | CO2+H2O+NaClO═NaHCO3+HClO | B. | CO2+H2O+2NaClO═Na2CO3+2HClO | ||
| C. | CH3COOH+NaCN═CH3COONa+HCN | D. | CH3COOH+NaClO═CH3COONa+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水显碱性:NH3•H2O═NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可以干燥SO2、H2等气体 | |
| B. | 常温下浓硫酸可以使Al、Fe发生钝化 | |
| C. | 浓硫酸可以使蔗糖发生炭化 | |
| D. | 用浓硫酸和NaCl固体加热制备HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
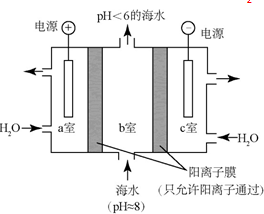
| A. | a室的电极接电源的负极 | |
| B. | 该装置将电能转化为化学能 | |
| C. | c室排出的碱液中含有NaOH | |
| D. | a室的电极反应式为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com