
【题目】将5mL物质的量浓度为18.4mol/L的浓硫酸加入水中,稀释成100mL溶液,所得稀硫酸的物质的量浓度是( )
A. 0.46mol/L B. 0.92mol/L C. 4.6mol/L D. 5mol/L
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体的性质无关的是
A. 土壤中离子的吸附和交换过程,有保肥作用
B. 由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
D. 臭氧可用于水的消毒净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.80g CuSO45H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示. 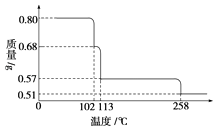
请回答下列问题:
(1)试确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为; 把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为 , 其存在的最高温度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-Fe2O3是一种具有磁性、催化等作用的纳米材料,以硫铁矿烧渣等为原料生产制备-Fe2O3的流程如下:
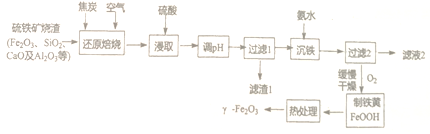
已知:“还原焙烧”的主要反应为:3C+2O2![]() 3CO↑+CO2↑,Fe2O3+CO
3CO↑+CO2↑,Fe2O3+CO![]() 2FeO + CO2
2FeO + CO2
回答下列问题:
(1)“浸取”前需将焙烧生成的混合物粉碎,其目的是_____________________。
(2)“滤渣1”除了CaSO4外还有_______________。
(3)常温下Ksp[Al(OH)3]=1.3×10-33。当常温下溶液pH=6时,c(Al3+)=____________。
(4)“过滤2”时需用蒸馏水洗涤,能证明己洗涤干净的方法是______________;
(5)沉淀缓慢氧化为铁黄的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com