
| A. | 用高效催化剂,可使CO2的平衡转化率增大 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的转化率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
分析 A.催化剂不能使化学平衡发生移动;
B.根据正逆反应速率是否相等平衡是否达到平衡状态;
C.减少生成物浓度,平衡正向移动;
D.升高温度平衡向吸热方向移动.
解答 解:A.用高效催化剂,平衡不移动,CO2的平衡转化率不变,故A错误;
B.单位时间内消耗CO2和H2的物质的量比为1:3时,表示的都是正反应速率,无法判断正逆反应速率是否相等,无法判断是否达到平衡状态,故B错误;
C.及时分离出CH3OH和H2O,化学平衡向着正向移动,反应物CO2和H2的转化率增大,故C正确;
D.CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应),所以升高温度平衡向逆向移动,故D错误;
故选:C.
点评 本题考查了化学平衡状态的判断、化学平衡的影响因素等知识,题目难度中等,注意掌握判断化学平衡状态的方法、催化剂只影响反应速率,不影响化学平衡的移动.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

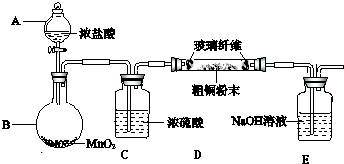
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
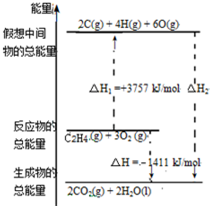 乙烯(C2H4结构式:
乙烯(C2H4结构式: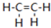 )既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)
)既可以做果实的催熟剂,也可以做燃料,燃烧时有关化学能量变化如图所示.断裂1mol化学键所需的能量(kJ):C=C为615、O=O为500、C-H为414、C=O为750,则断裂1mol O-H键所需能量是( )(已知:C2H4+3O2=2CO2+2H2O)| A. | 542 | B. | 391 | C. | 1834 | D. | 917 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H3>△H1 | B. | △H3>△H2>△H1 | C. | △H3>△H1>△H2 | D. | △H1>△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n>p | B. | A 的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6、-2 | +5、-3 | -2 | +3 |
| A. | 离子半径大小:R3+<X+<M2- | |
| B. | Y与M组成的化合物是光化学烟雾的原因之一 | |
| C. | 将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 | |
| D. | R的单质是铝热剂的成分之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com