

分析 (1)依据铜和稀硝酸反应的离子方程式,理解反应实质氢离子是硫酸和硝酸提供;尾气只要是一氧化氮、二氧化氮,需要和氧气混合通入碱溶液中完全吸收;
(2)固体灼烧应在坩埚内;
①依据Ksp和一般认为铁离子的浓度下降到10-5mol•L-1,就认为沉淀完全,计算溶液PH;
②调节溶液PH和溶液中氢离子反应,提高溶液PH,但不能引入新的杂质;
③亚铁离子在空气中易被氧化为铁离子,铜能溶解于含铁离子的溶液中;
④根据双氧水加热易分解的性质分析;
⑤依据固体条件结合得到硫酸铜晶体质量计算得到.
解答 解:(1)验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,依据离子反应实质,氢离子是硝酸和硫酸共同提供,氢离子分析可知最佳比为6:2,所以硫酸和硝酸物质的量之比最佳为3:2;吸收该反应中产生的尾气氮的氧化物需要通入氧气混合后通入氢氧化钠溶液被完全吸收;
A、一氧化氮不能被氢氧化钠吸收,故A错误;
B、空气和一氧化氮通入氢氧化钠溶液可以被吸收,故B正确;
C、空气未通入氢氧化钠溶液,一氧化氮不能在溶液中和氧气反应被氢氧化钠吸收,故C错误;
D、气体都未通入氢氧化钠溶液中,不能被吸收,故D错误;
故答案为:3:2;B;
(2)固体在空气中灼烧需要高温应在坩埚内完成,故答案为:坩埚;
①Ksp[Fe((OH)3]≈10-38 ,依据沉淀溶解平衡可知,c(Fe3+)×c3(OH-)=10-38,一般认为铁离子的浓度下降到10-5mol•L-1,
c(OH-)=10-11mol/L,c(H+)=10-3mol/L,pH=3,故答案为:3;
②除杂的原则,保证不引入杂质,加入氧化铜或碱式碳酸铜都能能和酸反应提高溶液PH,但不引进新的杂质,加入CaO、NaOH、Fe2(SO4)3会引入新的杂质离子,得不到纯净的硫酸铜晶体,故答案为:CD;
③反应中加入少量FeSO4可加速铜的氧化,亚铁离子酸性溶液中被空气中的氧气氧化为铁离子,铁离子溶解铜生成硫酸铁和硫酸铜,反应的两种方程式为:4Fe2++O2+4H+═4Fe3++2H2O; 2Fe3++Cu═2Fe2++Cu2+,故答案为:4Fe2++O2+4H+═4Fe3++2H2O,2Fe3++Cu═2Fe2++Cu2+;
④过氧化氢不稳定,温度过高易分解生成水和氧气,故答案为:防止双氧水分解;
⑤设3.2g铜生成五水硫酸铜的质量为xg,根据铜原子守恒得铜和五水硫酸铜的关系式为:
Cu→CuSO4•5H2O
64g 250g
3.2g xg
所以x=12.5g
理论上生成CuSO4•5H2O 12.5克,故产率为$\frac{10.6g}{12.5g}$×100%=84.8%,
故答案为:84.8%.
点评 本题考查了制备物质的实验设计和方案探究,实验装置的应用分析,物质性质的判断,氧化还原反应的分析,尾气处理方法,溶液PH的计算,制备物质产率计算,题目综合性强,需要扎实的基础知识,题目难度中等.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 500 mL | C. | 1000 mL | D. | 1500 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 生石灰与水混合的过程只发生物理变化 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

温度 溶解度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
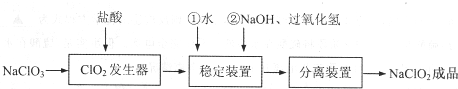
| 步骤Ⅰ | 称取NaClO2样品Wg,加水配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol•L-1的 Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中混有的苯酚可加入浓溴水后过滤 | |
| B. | 向淀粉溶液中滴加稀硫酸后,加热,再加入新制Cu(OH)2加热,没有出现红色沉淀,说明淀粉没有发生水解反应 | |
| C. | 向NaOH溶液中加入溴乙烷,加热,再加入AgNO3溶液,产生沉淀,说明溴乙烷发生了水解反应 | |
| D. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液褪色,说明维生素C有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com