
| A、H+、SO42-、Na+、SiO32- |
| B、Ag+、Fe3+、Cl-、SO42- |
| C、K+、SO42-、Mg2+、NO3- |
| D、H+、I-、Cl-、NO3- |
科目:高中化学 来源: 题型:
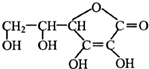
| A、维生素C可作食品添加剂 |
| B、维生素C具有抗氧化作用 |
| C、维生素C的分子式为C6H8O6 |
| D、维生素C加入紫色石蕊试液,溶液变红色,说明维生素C的水溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间生成nmol的C,同时生成2nmol 的AB |
| B、容器内的总压,不随时间变化 |
| C、容器内气体密度不变 |
| D、单位时间生成n mol的A2,同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、C的浓度相等 |
| B、容器中压强不再变化 |
| C、单位时间消耗nmol A,同时生成2n mol C |
| D、A、B、C的分子数比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用1mol/L FeCl3溶液制得氢氧化铁胶体的胶粒数目一定小于1NA |
| B、10L 18.4mol?L-1硫酸与64g铜加热反应,生成SO2分子的数目一定小于1NA |
| C、通常状况下,22.4L氯气与烧碱溶液完全反应,转移电子数目一定小于1NA |
| D、标准状况下,22.4LHF所含分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
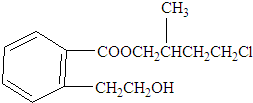 某有机化合物A的结构简式如图
某有机化合物A的结构简式如图
查看答案和解析>>
科目:高中化学 来源: 题型:
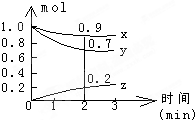 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO8- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

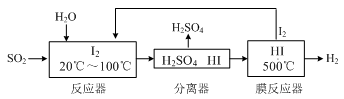
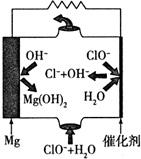
查看答案和解析>>
科目:高中化学 来源: 题型:
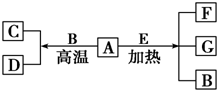 A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体.
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com