
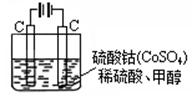


科目:高中化学 来源:不详 题型:单选题

| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.此装置能将化学能转变为电能 |
| B.石墨电极的反应式:O2+2H2O+4e—=4OH— |
| C.电子由Cu电极经导线流向石墨电极 |
| D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Z>X>Y>M>N | B.Z>Y>X>M>N |
| C.Z>X>Y>N>M | D.X>Y>M>N>Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
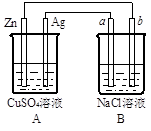
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
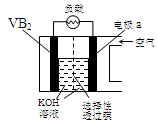
| A.电极a为电池负极 |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
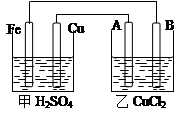
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
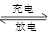 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )
2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是( )| A.PbO2放电时是电池的负极,充电时是电池的阳极。 |
B.负极的电极反应式为:Pb + SO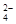 – 2e – = PbSO4 – 2e – = PbSO4 |
| C.放电时,PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
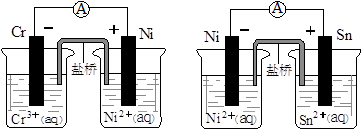
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com