
| A. | c(H+)+c(HA)=c(OH-) | B. | c(OH-)<c(H+)<c(B+)<c(A-) | ||
| C. | c(H+)+c(B+)<c(A-)+c(OH-) | D. | c(A-)=c(B+)>c(H+)=c(OH-) |
分析 常温时0.1mol•L-1HA溶液的pH=3>1,说明HA没有完全电离,应为弱酸,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,结合c(OH-)×c(H+)=1×10-14,可计算该碱溶液中c(OH-)=0.1mol/L,说明BOH完全电离,为强碱,二者反应后生成强碱弱酸盐,结合电荷守恒、质子守恒、盐的水解原理比较BA溶液中离子浓度大小.
解答 解:常温时0.1mol•L-1HA溶液的pH=3,说明HA没有完全电离,应为弱酸,
0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,
则:c(OH-)=$\frac{1{0}^{12}}{c({H}^{+})}$=$\frac{1{0}^{12}}{\frac{1{0}^{-14}}{c(O{H}^{-})}}$=0.1mol/L,说明BOH完全电离,为强碱,
等浓度、等体积的二者反应后生成强碱弱酸盐,溶液中存在A-+H2O?HA+OH-,呈碱性,则c(H+)<c(OH-),根据电荷守恒c(H+)+c(B+)=c(A-)+c(OH-)可知:c(A-)<c(B+),则溶液中离子浓度大小为:c(H+)<c(OH-)<c(A-)<c(B+),故B、D错误;
根据溶液电中性原则,则:c(H+)+c(B+)=c(A-)+c(OH-),故C错误;
根据BA溶液中的质子守恒可得:c(H+)+c(HA)=c(OH-),故A正确;
故选A.
点评 本题考查离子浓度大小比较、溶液酸碱性与溶液pH的计算等知识,题目难度中等,注意根据题目所提供的信息判断酸碱的强弱为解答该题的关键,明确电荷守恒、物料守恒、质子守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

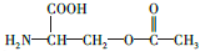 .
. b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
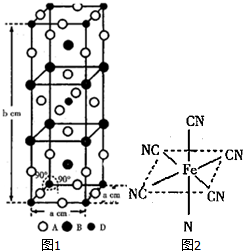
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 胶体是一种介稳性的分散系,其粒子能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com