
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K=____________________。
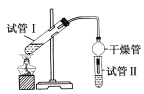
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6 mL 3 mol·L-1 H2SO4 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是____________mL和____________mol·L-1。
②分析实验____________(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率。浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是__________________。
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________________。
【答案】(1)![]()
(2)①6、6②A、C,浓H2SO4可以吸收酯化反应中生成的水,降低了生成物的浓度,使平衡向生成乙酸乙酯的方向移动③大量乙酸、乙醇未经反应就脱离反应体系;温度过高发生其他反应
【解析】
试题分析:(1)达到平衡,生成物浓度的幂之积和反应物浓度的幂之积的比值是化学平衡常数,则根据方程式可知K=![]() ;
;
(2)①对照实验其他条件相同,因此应加入6mL6mol·L-1盐酸;
②根据勒夏特列原理,要求其他条件不变,浓硫酸吸水性影响实验,因此是A、C两个实验做对照实验,浓H2SO4可以吸收酯化反应中生成的水,降低了生成物的浓度使平衡向生成乙酸乙酯的方向移动;
③乙醇和乙酸易挥发,高温下有大量的乙醇和乙酸挥发,造成乙酸乙酯的产率降低。


科目:高中化学 来源: 题型:
【题目】用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,下列操作会使测定结果偏低的有
A. 以酚酞作指示剂
B. 锥形瓶中有少量水
C. 滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失
D. 滴定前仰视滴定管读数,滴定后平视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4L恒容密闭容器中充入6mol A气体和5mol B气体,在一定条件下发生反应:3A(g)+B(g) ![]() 2C(g)+x D(g),达到平衡时,生成了2mol C,经测定D的浓度为 0.5molL﹣1,下列判断正确的是( )
2C(g)+x D(g),达到平衡时,生成了2mol C,经测定D的浓度为 0.5molL﹣1,下列判断正确的是( )
A.x=3
B.A 的转化率为 50%
C.平衡时 3V正(A)=2V逆(C)
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于气体摩尔体积的下列叙述中正确的是 ( )
A. 气体摩尔体积是单位物质的量的气体所占的体积
B. 标准状况下,气体摩尔体积约为22.4 L
C. 标准状况下,1 mol任何物质所占的体积约是22.4 L
D. 标准状况下,1 mol氢气所占的体积约是22.4 L·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 检测乙醇中是否含有水可加入无水硫酸铜,若固体变蓝则含水
B. 鉴别乙醇和水两种无色液体最简单的方法是闻其气味
C. 获得无水乙醇的方法是直接加热蒸馏
D. 获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示反应 N2(g)+3H2(g) ![]() 2NH3(g);ΔH=-92.2kJ/mol。在某段时间 t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
2NH3(g);ΔH=-92.2kJ/mol。在某段时间 t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是( )
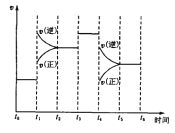
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含少量硫酸铁的硫酸钠固体,制取芒硝(Na2SO4·10H2O),操作流程图如下所示,请回答下列问题:
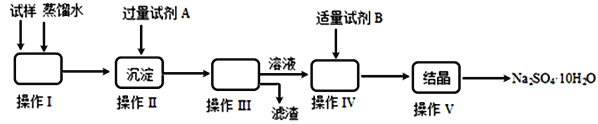
(1)操作I的名称是________;操作III所需的玻璃仪器有________________________。
操作V的步骤依次是________(用编号填入)
过滤 b.冷却 c.蒸发浓缩 d.蒸发至接近蒸干
(2)试剂A为__________;试剂B为__________,加入试剂B的目的是__________________,实验中加入适量试剂B的实验方案为___________________。
测定所得产品中结晶水含量的实验过程及数据如下,完成下列填空:
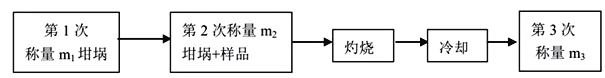
(3)计算所得产品中结晶水含量的表达式为___________________
(4)下列操作会导致结果偏高的是______________(选填编号)
a.坩埚未干燥 b.加热过程中有晶体溅失 c.晶体中含不挥发杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com