
 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )| A. | 常温下,PbI2的Ksp为2×10-6 | |
| B. | 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变 | |
| C. | T时刻改变的条件是升高温度,因而PbI2的Ksp增大 | |
| D. | 常温下Ksp(PbS)=8×10 -28,向PbI2的悬浊液中加入Na2S溶液,PbI2 (s)+S2- (aq) PbS(s)+2I- (aq)反应的化学平衡常数为5×l018 |
分析 A.PbI2饱和溶液存在沉淀溶解平衡:PbI2(s)?Pb2+(aq)+2I-(aq),根据图象和溶度积常数表达式计算;
B.温度不变,溶度积常数不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,增加了Pb2+,使反应向生成沉淀方向移动;
C.温度升高,Ksp常数增大,结合图象判断是否改变的条件为升高温度;
D.根据多重平衡规则计算该反应的平衡常数.
解答 解:A.PbI2饱和溶液存在沉淀溶解平衡:PbI2(s)?Pb2+(aq)+2I-(aq),根据图象,平衡时溶液中c(Pb2+)=1×10-3mol/L,c(I-)=2×10-3mol/L,则溶度积常数为Ksp(PbI2)=c(Pb2+)•c2(I-)=1×10-3×(2×10-3)2=4×10-9,故A错误;
B.温度不变,溶度积常数不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,增加了Pb2+,使反应向生成沉淀方向移动,则溶液中c(I-)减小,则c(Pb2+)增大,故B错误;
C.依据图象分析,T时刻I-浓度升高,Pb2+浓度降低,若改变的条件是升高温度,那么碘离子浓度与铅离子浓度应同时变大或变小,故此时不是改变的温度,故C错误;
D.向PbI2的悬浊液中加入Na2S溶液,PbI2 (s)+S2- (aq)?PbS(s)+2I- (aq),根据多重平衡规则,该反应的化学平衡常数为K=$\frac{{c}^{2}({I}^{-})}{c({S}^{2-})}$=$\frac{{c}^{2}({I}^{-})}{c({S}^{2-})}•\frac{c(P{b}^{2+})}{c(P{b}^{2+})}$=$\frac{{K}_{sp}(Pb{I}_{2})}{{K}_{sp}(PbS)}$=$\frac{4×1{0}^{-9}}{8×1{0}^{-28}}$=5×1018,故D正确.
故选D.
点评 本题考查了沉淀溶解平衡的移动和计算应用,溶度积常数的分析判断与计算,题目难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 | |
| B. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 | |
| C. | 离子键实质是阴、阳离子间的静电吸引力 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、NH4+、Cl-、SO42- | B. | Na+、H+、Cl-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
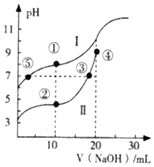 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中:c(CN-)=c(CH3COO-) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10种 | B. | 8种 | C. | 6种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 相同温度时,Ksp(BaSO4)>Ksp(BaCO3) | |
| B. | BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大 | |
| C. | 若使BaSO4全部转化为BaCO3,至少要加入1.25molNa2CO3 | |
| D. | BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为:c(CO32-)>c(SO42-)>c(OH-)>c(Ba2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 个 | B. | 6 个 | C. | 7 个 | D. | 8 个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com