
【题目】下列说法正确的是
A. 在配制一定物质的量浓度溶液的实验中量筒是必需仪器
B. 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞
C. 某未知液中加稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+
D. 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】将m g钠和铝的混合物放入n g足量水中,待反应停止后,得到a g沉淀,则滤液中的溶质是( )
A. NaAlO2 B. NaAlO2和NaOH C. Al(OH)3 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g) +H2(g)![]() CO (g) +H2O (g)
CO (g) +H2O (g)
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________。
(2)能说明该反应达到化学平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______℃。
(4) 830℃时,在1L密闭容器中分别投入lmolH2和lmolCO2反应达到化学平衡时,CO2的转化率为__________;保持温度不变,在平衡体系中再充入1molH2和lmolCO2重新达到化学平衡时,CO2的平衡转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
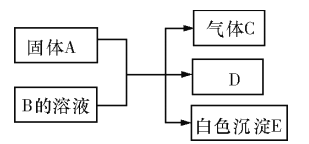
(1)若A是短周期中原子半径最大的元素构成的单质,E 既可溶于盐酸又可溶于NaOH ,E 溶于NaOH 溶液的离子方程式为___________;工业上冶炼A 的化学反应方程式为_________________。
(2)若A为红色金属,B 为某酸的浓溶液,C 为可形成酸雨的无色气体。则A 与B反应的化学方程式为___________________________。
(3)若B为某酸式盐的溶液,C 是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式为 _________________;0.1molC 完全燃烧生成液态水时放热130kJ·mol-1,则表达C 燃烧热的热化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体数目的叙述不正确的是( )
A. 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C. 含有5个碳原子的某饱和链烃,其一氯代物有3种
D. 菲的结构为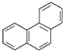 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨是造成世界范围内成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化……某研究小组探究某地硫酸酸雨的形成,他们提出以下猜想:
猜想一:![]()
![]()
![]()
![]()
![]()
猜想二:![]()
![]()
![]()
![]()
![]()
猜想三:以上两个过程同时存在。
为验证上述猜想,研究小组收集一定量该地区刚下的雨水进行实验,则下列判断中错误的是
A. 若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
B. 若存在猜想二的过程,则该雨水可能使品红褪色
C. 若只存在猜想一的过程,则该雨水的pH随时间延长而增大
D. 上述任意一个猜想正确,该地区雨水的pH均小于5.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下:G+F+H2O=2HNO2(已配平)。
请回答下列问题:
(1)石灰氮的化学式为_____________。
(2)写出足量B和C与饱和氯化钠溶液反应的化学方程式:__________________。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为_________(填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是__________(填序号)。
a. 磷酸 b. 二氧化碳 c. 稀硫酸 d. 二氧化硫 e. 次氯酸
(4)工业废水中的NO2― 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式:____________________________。若改用电解法将废水中NO2— 转换为N2除去,N2将在________(填电极名称)生成。
(5)某研究小组学生提出检验火柴头上KClO3实验方案如下:

有关的离子反应方程式为__________________________________________。
(6)在(5)方案基础上,要确定火柴头中含KClO3,还需进行的实验操作为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件可发生如下两个化学反应:
①Fe+H2SO4(稀)=FeSO4+H2↑ ②2Fe+6H2SO4(浓) = Fe2(SO4)3+3SO2↑+6H2O
试回答下列问题:
(1)反应①中_____元素被还原,氧化产物为__________;用单线桥表示该反应电子转移情况_________________;
(2)反应②中还原产物为__________,当反应②中生成32克SO2气体时,被还原的H2SO4有_______mol,用双线桥表示该反应电子转移情况____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com