
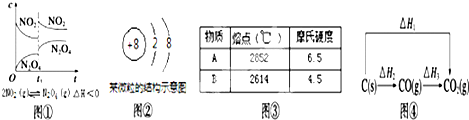
| A、图①t1时改变的条件可能是升高了温度或增大了压强 |
| B、图②该微粒仅为18O2-不能为16O2- |
| C、图③若A为CaO,则B可能为MgO |
| D、图④中的△H1<△H2 |


科目:高中化学 来源: 题型:
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
| B、试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 |
| C、实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 |
| D、试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| D | D元素的单质在C元素的单质燃烧,发出黄色火焰 |
| E | E与C形成的化合物H在大气中形成硫酸型酸雨 |
| F | 与E同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.| NaOH溶液 |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
| B、一次电池是最常见的化学电源,一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用,铅蓄电池是最常见的一次电池 |
| C、氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| D、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
| C、氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料 |
| D、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com